Warum besitzt Schwefel in Schwefelsäure 12 Valenzelektronen?
3 Antworten
Ach ne, die Hyperkonjugation mal wieder!
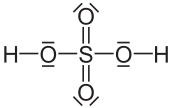
Der Schwefel wird im Molekül der Schwefelsäure manchmal 6-bindig dargestellt. Demzufolge hätte er ja 12 Außenelektronen? (siehe Bild 1)
Für ein Element der 3. Periode muss das Oktett streng gelten (8 e-)
Der Knackpunkt ist, dass die zwei pi-Bindungen der O-Atome jeweils gar nicht mit zu den "Außenelektronen" des Schwefels gezählt werden.
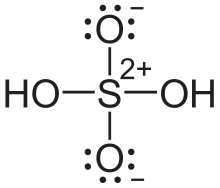
Diese "außergewöhnliche" pi-Bindung rührt aus einem intramolekularen Ladungsausgleich (vgl.Bild 2) Das Schwefelatom wäre - bei einbindigem Sauerstoff - mit +2 geladen. Die Sauerstoffatome hätten eine negative Formalladung.
Jetzt kommt es zu einer schwachen Bindung zwischen den nicht bindenden Außenelektronen vom Sauerstoff und dem antibindenden s-Molekülorbital des Schwefels. Das nennt man dann Hyperkonjugation.. Moleküle machen das häufig, da es energetisch günstiger ist. Achtung: Im Gegensatz zu einer "normalen" kovalenten Bindung, steuert hier nur das Sauerstoffatom die Bindungselektronen bei (klappt sie sozusagen um)..
i.A. Ist die Strukturformel mit der geringsten Anzahl an Formalladungen,die Wahrscheinlichste. (Gegenbeispiel: Salpetersäure)
Die Ladung ist übrigens im Sulfat-Ion über alle 4 O-Atome delokalisiert.
Dieser Effekt macht das Ion besonders stabil; es ist auch nur eine sehr schwache Base!
In unserem betrachteten Molekül sind die 4-Hyperkonjugations-Elektonen :'D auch über 3 Atome hin verteilt (Mehrzentrenbindung). --> O-S-O
Wichtig ist noch, zu sagen, dass sich die hyperkonjugierten Elektronen nicht zwei Atomen zuordnen lässt; sie verteilt sich über mehrere Atome oder das ganze Molekül hinweg.. ;)
Ich hoffe, ich kam noch rechtzeitig! *g*
LG
Schon mal was davon gehört zu haben schadet nie - der eine versteht das, der andere nicht..
Ich meine die antibindenden sigma-Orbitale des Zentralteilchens. Freie Elektronenpaare würde ich als nicht bindend bezeichnen..
Hyperkonjugation also, ist es schlimm, dass ich nicht weiß, was ich mir darunter vorstellen kann?
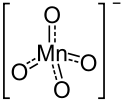
Ein weiteres, gutes Beispiel ist das Permanganat-Ion:
Dadurch kann die negative Ladung (ebenso wie die Doppelbindungen) zwischen den Sauerstoffatomen hin und her wechseln...
Bildquelle: https://de.wikipedia.org/wiki/Permanganate#/media/File:Permanganat-Ion2.svg
Mangan ist aber ein Übergangselement, da sind die 3d-Orbitale voll dabei.
Vielleicht kann man das mit Schwefel (oder in diesem Fall besser mit Chlor) vergleichen, aber sicher nicht so einfach, mit einem Bild.
Im Jander-Blasius stand, dass im Permanganat nicht wie früher oft angenommen, durch die pi-Bindungen d/p-Orbitale "aufgefüllt" werden.
Es wechselwirken tatsächlich antibindende Molekülorbitale mit den Außenelektronen vom O.
Schwefel hat in H2SO4 keine 12 Valenzelektronen. Die Wertigkeit von Sauerstoff ist höher als die von Schwefel. Deshalb hat vielmehr der Sauerstoff die Valenzelektronen des Schwefels. Jedes O hat damit ein volles Oktett. Dem Schwefel fehlen alle 6 Valenzelektronen. Deshalb hat auch dieser ein volles Oktett.
Ich nehme an, Du meinst nicht die Wertigkeit sondern die Elektronegativität?
Diese ganze "Hyperkonjugation" scheint aber auch eher ein Modell vor einem präzisen Verständnis zu sein.
s-Orbitale sind Atomorbitale, die sind nicht bindend oder antibindend.
So wenig wie "freie Elektronenpaare".
Das MO-Modell ist allerdings eher noch schwieriger verständlich.
Für den Fragesteller dürfte das egal sein.
P.S. Kritisch ist eher das Zu-Früh-Kommen.