UV-VIS-Spektrum (d-d-Übergänge)?
Hallo, ich soll sagen, wieviele d-d-Übergänge man bei dem Komplex (Cu(NH3)4(H2O)2)2+ im UV-VIS-Spektrum sehen würden... kann mir jemand erklären woher ich das weiß? Gibt es vielleicht eine Erklärung mit dem Ligandenfeld? Cu2+ hat ja nur ein ungeplantes Elektron, würde man dann evtl. einen Übergang sehen also wenn ein Elektron von t2g in eg angehoben wird?
Danke, LG
1 Antwort
Dazu nimmst Du am besten ein Tanabe-Sugano-DIagramm für d⁸
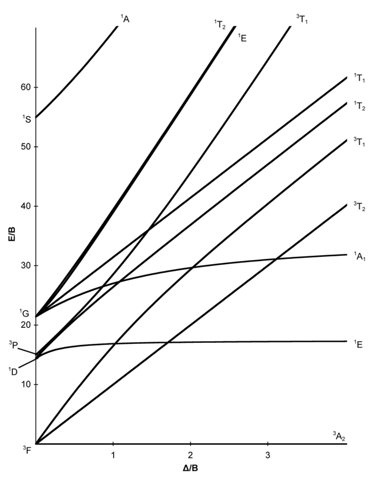
Du siehst, daß der Grundzustand ein ³A₂ ist; der kommt von einem Atomterm ³F, und von dem kommen noch zwei weitere Spaltterme, ³T₁ und ³T₂. Außerdem gibt es noch einen weiteren Triplett-Atomterm ³P, der im oktaedrischen Ligandenfeld nicht weiter aufspaltet und einen weiteren ³T₁ ergibt. Ich habe keine Ahnung, warum in diesem DIagramm der g-Deskriptor in d
Also sind (jenseits von spinverbotenen Banden und charge-transfer-Übergängen, die alle nicht plausibel erscheinen) maximal drei Absorptionen zu erwarten.
Du siehst, daß je nach Ligandenaufspaltung Δₒ (x-Achse) zwei Terme näherungsweise dieselbe Energie haben können, oder daß ein Term unrealistisch hoch liegen könnte. Deshalb könnten im experimentellen Spektrum auch nur zwei Banden zu sehen sein. Leider habe ich kein experimentelles Spektrum gefunden.
Allerdings haben wir hier ziemlich viel geschludert, weil dieser Komplex ja gar nicht oktaedrisch ist, sondern stark tetragonal verzerrt.
Un wirst Du viell
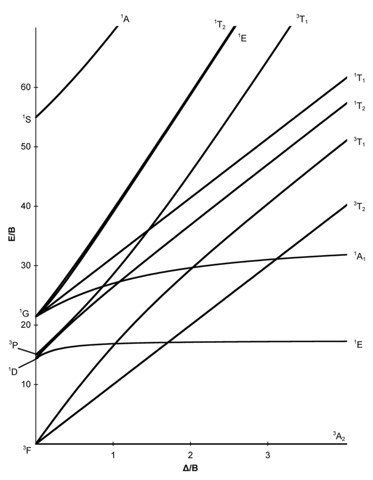
Das TS-Diagramm zeigt Dir doch genau, wie die Atomterme (die alle aus einer d⁸-Besetzung resultieren) im Ligandenfeld aufspalten.
Ich meine aber, wie man die Anzahl an d-d-Übergänge ohne ein solchen Diagramm sondern nur mit Ligandenfeldargumente erklären könne
Danke!
Und wie kann man diese drei Absorptionen beispielsweise mit dem Ligandenfeld erklären?