Titrierbar?
Hallo,
kann jemand mir bitte bitte mit einfachen Worten erklären, was titrierbar bedeutet?
Titrierbar Säure/ Base, Säure/Base ist schon klar nur das Wort 'titrierbar'
Vieeelen Dank im Voraus
3 Antworten
Titrierbar bedeutet, dass man einen Stoff mit einem anderen Stoff titrieren kann.
Titrieren bedeutet, dass man die Konzentration eines Stoffes bestimmt, in dem einen anderen Stoff (die Konzentration von diesem Stoff ist bekannt) Tropfen für Tropfen zugibt. Über einen Indikator lässt man sich anzeigen, wenn der Stoff mit unbekannter Konzentration vollständig wegreagiert ist.
Ich habe am Donnerstag mit meinen Schülern folgendes Experiment gemacht:
- In einem Reagenzglas ist 1 ml Salzsäure mit unbekannter Konzentration
- Gebe mit einer 1-ml-Spritze so lange tropfenweise Natronlauge dazu, bis die Lösung neutral ist.
Das war eine Titration.
Gerne.
Ammonium-Ionen sind viel zu schwache Säuren um titriert werden zu können. Das heißt, das Ammonium-Ion reagiert einfach nicht gut genug mit Natronlauge oder einer anderen Base.
Ja, das bedeutet, dass Ammoniumverbindung nicht einfach titriert werden können. Es gibt aber den Ausweg der Formol-Titration. Da gibt man zu der Ammoniumlösung noch Formaldehyd dazu, dabei entsteht aus dem Ammonium-Ion eine neue Verbindung, die titrierbar ist.
Vermutlich heißt titrierbar, daß eine Titration in der Praxis funktioniert, also daß man einen Endpunkt detektieren kann.
Das muß nicht unbedingt der Fall sein, denn je schwächer die Säure und je verdünnter die Lösung, umso geringer fällt der pH-Sprung am Äquivalenzpunkt aus. Wenn man Pech hat, ist er so gering, daß die notwendige Sprunghöhe von ⪆ 2 pH-Einheiten nicht erreicht wird, und dann kann man ihn mit Indikatoren nicht mehr sehen. Mit der pH-Elektrode geht es immer noch, aber es wird immer ungenauer.
Als Beispiel zeige ich Dir die Titration einer 0.1 mol/l HCN (pKₐ=9.4) mit 0.1 mol/l NaOH. Der Sprung 20 ml ist nicht nennenswert, die erste Ableitung (weiße Kurve) zeigt ein häßlich breites Maximum und Du siehst auch, daß am Äquivalenzpunkt noch Reste HCN (roter Hintergrund) im Gleichgewicht vorhanden sind, weil NaCN so stark hydrolysiert.
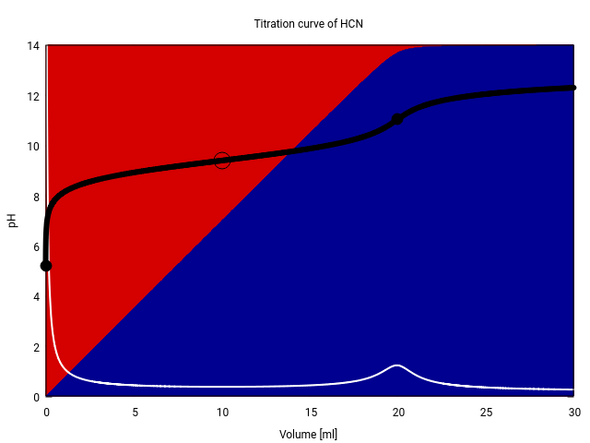
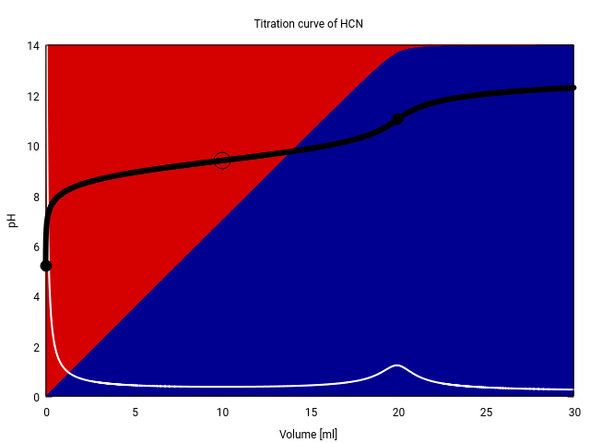
„Titrieren heißt, die unbekannte Menge eines gelösten Stoffes dadurch ermitteln, daß man ihn quantitativ von einem chemisch wohl definierten Anfangszustand in einen ebensogut bestimmten Endzustand überführt, und zwar durch Zugabe einer geeigneten Reagenslösung, deren chemischer Wirkungswert bekannt ist, und deren ...
Vielen Dank, und können Sie mir bitte bei einer anderen Frage helfen und zwar, was bedeutet es jetzt, dass Ammonium nicht titrierbar ist?
Heißt es, dass ich mit Hilfe einem anderen Substanz die Konzentration von Ammonium nicht bestimmen kann
Und warum ist Ammonium nicht titrierbar.
Vielen Dank noch einmal 🌷🌷