Welche Bedeutung haben die Äquivalenzpunkte bei einer Säure-Basetitration (Mehrprotonige Säure/starke Base) und wo finde ich Diagrame zum Thema?
Welche Bedeutung haben die Äquivalenzpunkte bei einer Säure-Basetitration mit mehrprotonigen Säuren und starken Basen? (im Diagram) Warum kommt es bei den weiteren Äquivalenzpunkten zu einer geringeren Steigung des pH-Wertes? Gerne könnt ihr mir auch Links nennen. Wenn ihr Zeit habt höre ich gerne noch mehr zu dem Thema! Ich hoffe auf heutige Antworten, auch wenn sie spät kommen! Willkomen sind ebenfalls Diagrame zum Thema (es sollte sich aber um mehrprotonige Säuren und starke Basen handeln). Vielen Dank! LG
2 Antworten
Diagramme findest Du selber. Suche nach Titration und einer der Säuren Phosphor-, Schwefel-, Oxal-, Kohlen-, Borsäure
Zeichne Dir die "Titrations"-kurve von reinem Wasser mit NaOH auf, da kannst Du den pH ja berechnen.
Wegen der logarithmischen Skala (von pH=9 auf 10 brauchst Du zehnmal so viele OH- wie von 8 auf 9) läuft die Kurve immer umso flacher, je weiter Du ins Alkalische kommst.
Wenn es um den mittleren Äquivalenzpunkt bei einer dreiprotonigen Säure geht, kommt noch hinzu, dass der pH-Bereich eingeengt wird durch die Umschlagbereiche links und rechts davon. Weniger Spielraum 0 weniger Steilheit.
Wenn Du eine mehrprotonige Säure mit NaOH titrierst, dann erzeugst Du nacheinander die verschiedenen Salze. Z.B. nehmen wir Phosphorsäure:
H₃PO₄ + NaOH ⟶ NaH₂PO₄ + H₂O
NaH₂PO₄ + NaOH ⟶ Na₂HPO₄ + H₂O
Na₂HPO₄ + NaOH ⟶ Na₃PO₄ + H₂O
(Natürlich dissoziieren die Salze in Wasser, man kann also auch nur die Ionen anschreiben.)
Wenn Du die Titration mit H₃PO₄ beginnst, dann erreichst Du irgendwann einen Punkt, an dem Du genau soviel NaOH zugegeben hast, daß die Lösung genau so zusammengesetzt ist wie eine Lösung von NaH₂PO₄ in Wasser (dabei dominiert das Ion H₂PO₄⁻, aber weil es ja noch die verschiedenen Säuregleichgewichte gibt, findet man auch noch kleine Mengen der anderen Phosphor-Biester darin).
Das ist der erste Äquivalenzpunkt. Am zweiten (mit doppelt so viel Basenverbrauch) entspricht die Zusammensetzung genau einer Lösung von Na₂HPO₄, und am dritten hast Du dann eine Na₃PO₄-Lösung.
An einem Äquivalenzpunkt kann es einen pH-Sprung geben. Muß aber nicht sein. Das hängt von etlichen Details ab, vor allem den Säurekonstanten (wenn die engt beieinander liegen, oder wenn die Säure sehr schwach ist, dann kann man oft gar nichts sehen), aber auch von der Verdünnung (in konzentrierten Lösungen sieht man mehr).
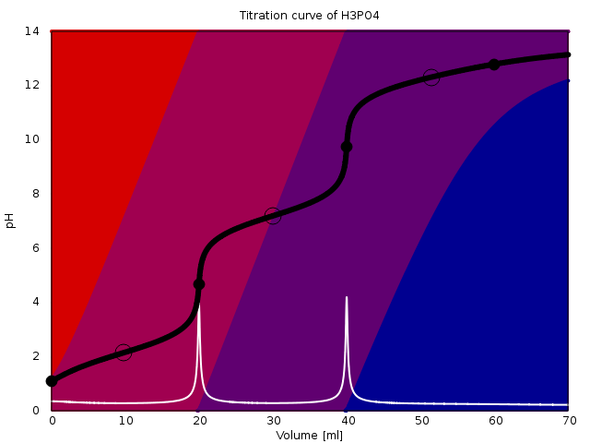
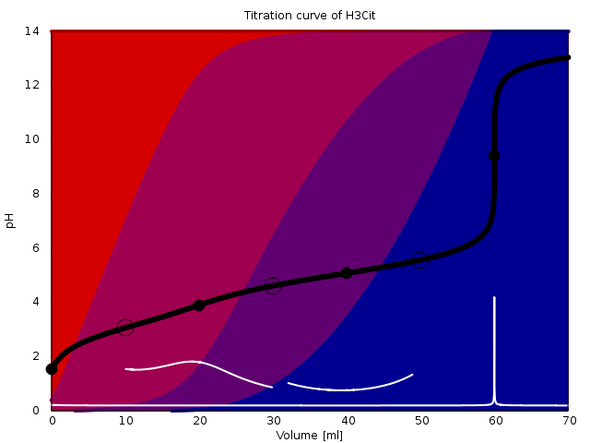
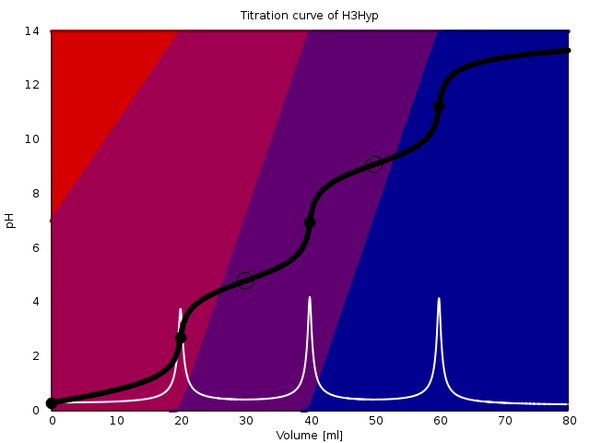
Ich wüßte nicht, wo Du Dir Titrationskurven im Netz ansehen kannst, aber ich kann welche für Dich berechnen. An diese Antwort hänge ich drei an, die verschiedene Effekte zeigen. In jeder davon werden 20 ml einer einmolaren dreibasigen Säure mit 1 mol/l NaOH titriert (ohne Zugabe von weiterem Wasser).
Die Plots sind ziemlich raffiniert: Sie zeigen die Titrationskurve (schwarz), deren erste Ableitung (weiß) und die Gleichgewichtszusammensetzung der Lösung als Farbwerte im Hintergrund (rot für die reine Säure, blau für die vollständig deprotonierte Form, und rotviolett bzw. blauviolett für die teilweise deprotonierten Ionen).
Die Äquivalenzpunkte sind mit schwarzen Vollkreisen markiert, die Ringe bezeichnen den Punkt, an dem die Gleichgewichtskonzentrationen zweier Spezies gleich groß sind.
(Wer das Programm haben will und sich vor ein bißchen Linux-Commandline nicht fürchtet soll mir schreiben)
Das erste Beispiel ist Phosphorsäure (pKₐ=2.148, 7.198, 12.319). Man sieht die ersten beiden Stufen gut, die dritte so gut wie gar nicht. Das liegt daran, daß der pK₃ sehr hoch ist (PO₄³⁻ ist eine relativ starke Base bzw. HPO₄²⁻ ist eine ganz schwache Säure).
Das zweite Beispiel ist Zitronensäure (pKₐ=3.09, 4.75, 5.41). Die drei sind einander so ähnlich, daß man keine pH-Sprünge bei den ersten beiden Äquivalenzpunkten sehen kann, dafür ist dann der dritte sehr stark. Das äußert sich auch darin, daß bei ca. 28 ml Verbrauch eine Lösung erreicht wird, in der alle vier Citrat-Spezies in merklichen Konzentrationen nebeneinander vorliegen; sowas puffert und unterdrückt pH-Sprünge.
Das letzte Beispiel hat die pKₐ-Werte 0.3, 4.8 und 9.1. Hier sieht man perfekt alle drei Äquivalenzpunkte als hübsch gleich hohe Sprünge. Leider kenne ich keine Säure mit genau diesen pKₐ-Werten, sonst wäre das ein netter Schülerversuch.
(Wenn Du mehr Kurven haben willst: Mein Programm rechnet sie gerne aus)