Moleküle/Atome?
Hallo,
Ich wollte fragen, wieso energiärmere Moleküle chemisch stabiler aks energiereiche Moleküle sind. Außerdem wollte ich fragen, wieso, wenn zwei Atome (H2) miteinander ein Molekül eingehen, Bindungsenergie freigesetzt wird. Wodurch genau wird diese Bindungsenergie freigesetzt?
2 Antworten
Moin,
das eine ist doch eigentlich ziemlich logisch:
Der energieärmste Zustand ist im Allgemeinen am erstrebenswertesten. Stell dir (nicht völlig passend) dich selbst vor. Du liegst auch lieber faul vorm Fernseher als dein Zimmer aufzuräumen. Rumliegen kostet dich weniger Energie als Aufräumen.
Oder (etwas genauer passend): so lange du lebst, steckst du viel Energie in den Erhalt deines Körpers. Deshalb musst du ständig Nahrung aufnehmen. Wenn du tot bist, gibt es diese zusammenhaltenden Kräfte nicht mehr und du zerfällst (verwest).
So ist es auch bei Molekülen. Sie haben einen Energiegehalt. Wenn es aber eine Kombination von Bindungspartnern gibt, die energieärmer ist, wird diese bevorzugt.
Darum sind energieärmere Verbindungen stabiler als energiereichere.
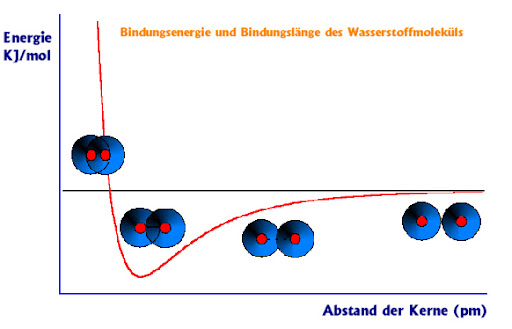
Was die Sache mit dem Wasserstoff angeht, schau mal hier:

Hier siehst du den Energiegehalt über dem Abstand von zwei Wasserstoffatomen aufgetragen (rote Linie).
Wenn zwei einzelne Wasserstoffatome vorliegen (rechts), dann haben sie zusammen einen gewissen Energiewert (schwarze Gerade).
nähern sich die beiden Wasserstoffatome einander an (zweites Bild von rechts), so sinkt der Energiegehalt ein bisschen. Das liegt daran, dass sich zwar die Elektronen in beiden Atomhüllen voneinander abstoßen (weil sie beide negativ geladen sind und sich gleichsinnige Ladungen voneinander abstoßen), aber gleichzeitig üben die postiv geladenen Atomkerne des Atoms eine anziehende Kraft auf die Elektronen des jeweils anderen Atoms aus (auf ihre eigenen Elektronen natürlich auch). Diese Anziehungskraft wird umso größer, je näher sich die beiden Atome kommen. Deshalb fällt der Energiegehalt immer weiter ab.
Irgendwann ist der Energiegehalt am kleinsten (zweites Bild von links). Dann überlappen sich die Hüllen der beiden Atome optimal, so dass sich die positiv geladenen Kerne noch nicht zu nahe sind, aber die Elektronen durch die Anziehung zwischen entgegengesetzt geladenen Teilchen im Überlappungsbereich der Hüllen gehalten werden.
Dieser Zustand entspricht der Bindung der beiden Wasserstoffatome miteinander. Er ist der energieärmste Zustand (Tiefpunkt der roten Linie), so dass du sagen kannst, dass die Bindung zustande kommt, weil dann der Abstand der beiden Wasserstoffatome zueinander optimal ist. Alle anderen Abstände der beiden Wasserstoffatome zueinander sind energiereicher. Deshalb setzt der optimale Abstand Energie frei, die Bindungsenergie.
Wenn du die beiden Wasserstoffatome einander noch weiter annäherst (linkes Bild), dann steigt die Energie rasant. Das liegt daran, dass sich nun nicht nur die beiden Elektronen nahe sind, sondern auch die beiden Wasserstoffkerne. Da die Kerne positiv geladen sind, wirken abstoßende Kräfte zwischen ihnen. Je näher du die Kerne zueinander drängst, um so stärker stoßen sie sich voneinander ab. Oder anders gesagt, du musst viel Energie aufbringen, um sie näher zusammenrücken zu lassen. Deshalb ist dieser Zustand zunehmend energiereicher.
Fazit:
Die chemische Bindung setzt Energie frei, weil dabei ein Abstand zwischen den Bindungspartnern geschaffen wird, der optimal ist. Optimal heißt in diesem Zusammenhang, dass die Anziehungskräfte zwischen den positiv geladenen Atomkernen und den Elektronen des Bindungspartners am ausgewogensten ist.
Alle anderen Abstände sind energiereicher.
Alles klar?
LG von der Waterkant
Wenn die Atome einen optimalen Abstand zueinander haben, wirken zwischen den beiden positiv geladenen Atomkernen gerade noch keine Abstoßungskräfte, so dass du keine Energie aufwenden musst, um sie in dieser Position zu halten. Was aber wirkt, sind Anziehungskräfte zwischen den negativ geladenen Elektronen im Überlappungsbereich der Atomhüllen und den beiden Kernen. Auch deshalb bleiben beide Atome relativ stabil in diesem Abstand. Du musst also keine Energie aufwenden, um die Atome in diesem optimalen Zustand zu halten (= energieärmster Zustand).
Wenn du nun aber die Atome näher zusammenrücken lässt, dann kommen Abstoßungskräfte (Coulomb-Kräfte) zwischen den gleichsinnig geladenen Kernen auf. Weil die sich voneinander abstoßen, musst du Energie aufbringen, um sie in der näher beieinanderliegenden Position zu halten. Die Energie steigt also, um die neue Position zu erzwingen. Deshalb hat das System nun mehr Energie, ist energiereicher.
Genauso umgekehrt: wenn du den Abstand zwischen den Atomen vergrößerst, wird die Anziehungskraft zwischen den Elektronenhüllen und den Kernen kleiner. Auch hier musst du also Energie aufwenden, um die Atome aus ihrem optimalen Abstand zu holen, sprich um die Bindung zu lösen. Auch das führt dazu, dass die Gesamtenergie des Systems steigt.
Insgesamt betrachtet ist die Coulomb-Abstoßungskraft zum Teil deutlich größer als die schwächer werdende Anziehungskraft bei der Trennung der Atome. Deshalb rast der Energiewert beim Zusammendrücken der Atome rasant nach oben, während die Energie bis zu dem Zeitpunkt, wo zwei Einzelatome vorliegen, ruhiger ansteigt und am Ende einen stabilen Wert erreicht (siehe Kurve im Diagramm meiner Antwort).
Übrigens: Wenn du es schaffst, die beiden Wasserstoffatome so nah zueinander zu bringen, dass ihre Kerne miteinander verschmelzen (Kernfusion), dann käme eine dritte Kraft ins Spiel, nämlich die Kernkraft. Das ist eine Kraft, die um vieles größer als die Coulomb-Kraft ist und die bewirkt, dass die Protonen in einem Atomkern zusammengehalten werden.
Wenn du es also schaffen würdest, die Coulomb-Abstoßungskraft bei der Kernfusion zu überwinden, dann würde wieder enorm viel Energie freigesetzt werden und die Energiekurve würde noch tiefer sinken als bei den verbundenen Wasserstoffatomen. Aber das wäre schon kein chemisches, sondern ein physikalisches Thema (Kernphysik).
Fazit:
Die Energie, von der hier immer die Rede war, ist entweder die Energie, die du aufwenden musst, um gleichsinnig geladene Ladungsträger näher zusammen zu bringen (Überwindung der Coulomb-Abstoßungskraft) oder die Energie, die nötig ist, um die Atome voneinander zu trennen.
In beiden Fällen musst du in den energieärmsten Zustand Energie hineinstecken, so dass die Zustände energiereicher werden...
Anders (besser) kann ich es dir nicht erklären.
Ich wollte fragen, wieso energiärmere Moleküle chemisch stabiler aks energiereiche Moleküle sind
Du hast die Frage gerade selbst beantwortet. Energiereiche Moleküle reagieren mit fast allem bzw leichter mit anderen Stoffen sind also instabil.
Ich verstehe zwar die Erklärung jedoch nicht den Zusammenhang zwischen energiereich und Anziehungskraft, beziehungsweise der chemischen Stabilität. Was heißt Energie in diesem Zusammenhang? Also, wenn ich sage die haben die größte Energie, stell ich mir immer vor, diese ziehen sich am stärksten an, was ja genau umgekhert ist. Aber wieso ist die Energie bei sich abstoßenden Atomen größer als bei "nichg abstoßenden" (beziehungsweise schwach abstoßenden). Chemisch am stabilsten sind ja diejenigen, die sich am stärken anziehen, sodass es nur schwer ist, ihre äußere Struktur zu verändern.