Moleküle Ionen?
Ich wollte fragen, was der Unterschied zwischen polarisierten Molekülen (Dipole) und Ionen sind (chemisch betrachtet). Irgendwie kann man ja die Unterschiede mit der En Differenz bestimmen.
2 Antworten
Moin,
das erfordert aber ein bisschen Hintergrundwissen. Ich hoffe, dass du das hast...
Ionen und Dipole sind verschiedene Dinge.
Ionen haben eine echte elektrische Ladung. Sie können positiv geladen sein (dann nennt man sie auch Kationen) oder sie können negativ geladen sein (dann heißen sie auch Anionen).
Entgegengesetzt geladene Ionen ziehen sich elektrostatisch gegenseitig an. Gleichsinnig geladene Ionen stoßen sich gegenseitig voneinander ab.
Dipole sind dagegen Teilchen, in denen es KEINE echten Ladungen gibt, die aber zwei entgegengesetzt TEILGELADENE Pole (Partialladungen) haben (di = zwei, Pol = Teilbereiche eines Teilchens).
Die Dipol-Teilchen können (große) Atome sein, sind aber eher Moleküle mit Atombindungen.
Die echte elektrische Ladung entsteht dadurch, dass ein Teilchen Elektronen (negative Ladungsträger) aufnimmt (dann entstehen Anionen) oder abgibt (dann resultieren Kationen).
Die Dipole entstehen dagegen durch eine Ungleichverteilung von Elektronen. Meist sind das bindende Elektronenpaare in einer Atombindung.
Und was hat das jetzt mit der von dir angesprochenen Elektronegativitätsdifferenz zu tun? - Nun, unter Elektronegativität versteht man ein relatives Maß für die Stärke, mit der ein Atomrumpf ein bindendes Elektronenpaar zu sich heran zieht.
Nimm als Beispiel das Chlor-Minimolekül (Cl2).

Die beiden Atomrümpfe sind über EIN BINDENDES Elektronenpaar miteinander verbunden (außerdem gibt es an jedem Cl-Atom noch drei freie, nicht-bindende Elektronenpaare).
Ein Chloratomrumpf hat eine Elektronegativität (EN) von 3,0. Das bedeutet, dass beide Chloratome an dem bindenden Elektronenpaar gleich stark ziehen. Dadurch liegt das Elektronenpaar auch genau in der Mitte zwischen den beiden Atomrümpfen. Es ist nicht zu einem der beiden hin stärker verschoben. Es gibt zwar ein leichtes Hin- und Herschwappen der Elektronendichte, aber im Mittel befindet sich das Elektronenpaar genau zwischen den beiden Atomrümpfen.
Die Folge ist eine völlig unpolare Atombindung.
Die EN-Differenz beträgt (3,0 – 3,0 =) 0.
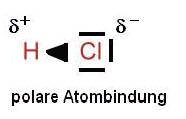
Wenn du das mit einem Chlorwasserstoff-Molekül vergleichst, ist das anders:

Auch hier sind das Wasserstoff- und das Chloratom über ein bindendes Elektronenpaar miteinander verbunden (wobei das Chloratom auch hier noch über drei freie, nicht-bindende Elektronenpaare verfügt).
Aber das bindende Elektronenpaar zwischen den Atomrümpfen liegt nicht in der Mitte, sondern ist zum Chloratom hin verschoben (sie den Keil in der Abbildung: das dicke Ende zeigt zum Cl-Atom).
Das liegt daran, dass ein Cl-Atom im Vergleich zu einem Wasserstoffatom eine größere EN hat. Darum zieht das Chloratom stärker an dem bindenden Elektronenpaar als der Wasserstoffatomrumpf.
Die EN-Differenz: (3,0 – 2,2 =) 0,8.
Das bedeutet, dass der Cl-Atomrumpf das bindende Elektronenpaar stärker zu sich heran zieht und dadurch vom H-Atom weg. Das führt nun dazu, dass das Cl-Atom etwas negativer geladen ist als das H-Atom, den das bindende Elektronenpaar besteht ja immerhin aus negativen Ladungsträgern. Und wenn die negativen Ladungsträger stärker zum Cl-Atom hin verschoben sind, wird das Cl-Atom negativ teilgeladen. Es ist aber nur eine Teilladung, weil das Cl-Atom nicht stark genug ist, um ohne Hilfe dem H-Atom das Elektronenpaar vollständig abzunehmen.
Das Resultat ist eine polare Atombindung (mit einem positiv teilgeladenen Bereich am H-Atom und einem negativ teilgeladenen Bereich am Cl-Atom.
Eine polare Atombindung ist die erste Voraussetzung dafür, dass ein Molekül ein permanenter Dipol sein kann.
Was nun noch mit hineinspielt, ist die Molekülgeometrie. Ein permanenter Dipol entsteht nur, wenn das Molekül (als Kugel gedacht) zwei entgegengesetzt teilgeladene Bereiche hat.
Wenn du dir nun noch die Verbindung zwischen Natrium und Chlor anschaust, dann erhältst du folgende EN-Differenz: (3,0 – 1,0 =) 2,0.
Diese Differenz ist bereits so groß, dass das Chloratom das Elektron dem Natriumatom ganz wegnimmt. Dadurch hat das Natriumatom nun ein Elektron weniger, während das Chloratom ein Elektron mehr besitzt.
Das führt dazu, dass das ehemalige Chloratom nun eine echte negative Ladung hat und somit zu einem Chlorid-Anion wird. Das ehemalige Natriumatom wird dagegen zu einem einfach positiv geladenen Natrium-Kation.
Die entgegengesetzt echt geladenen Ionen ziehen sich gegenseitig an; es entsteht eine Ionenverbindung (ein Salz) mit Ionenbindungen.
Grob kannst du dir folgende Faustregeln zur EN-Differenz merken:
EN-Differenz: 0,0 bis 0,4 → unpolare Atombindung
EN-Differenz: 0,5 bis 1,7 → zunehmend stärker polar werdende Atombindung
EN-Differenz: >1,7 → Ionenbindung
Dipole sind also Teilchen mit einer ungleich verteilten Elektronendichte, wodurch Teilladungen (Partialladungen) entstehen.
Ionen sind dagegen Teilchen mit einer echten elektrischen Ladung, die dadurch zustande kommt, dass es zur Übergabe von Elektronen kommt.
Alles klar?
LG von der Waterkant
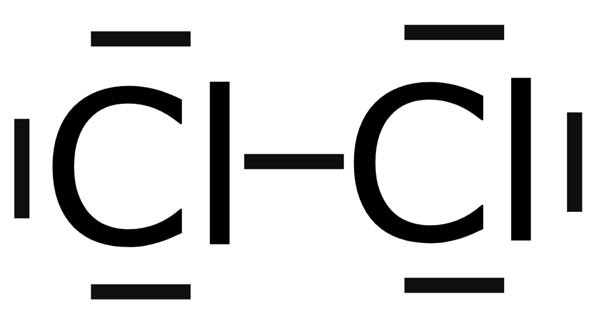
Hallo! Ich versuche mal zu erklären
Was Polarität ist
Und was Ionen sind
Sind zwei völlig verschiedene Dinge!
Ein Ion ist zum Beispiel Na+ oder Cl-
Und ein Molekül heißt irgendeine Verbindung aus zwei verschiedenen Elementen oder mehr
Wie beispielsweise NaCl oder Cl2
Aber Du gehst nicht darauf ein, was Polarität ist und was genau ein Ion ist und Deine Erklärung zu einem Molekül ist falsch