Kann man NaHCO3 mit NaOH titrieren?
Hallo,
ich muss eine Titration durchführen und meine Aufgabe ist NaHCO3 mit NaOH zu titrieren. Kann man das überhaupt? Wie soll die Titrationskurve aussehen?
P.s
Könnt ihr mir eventuell mit Formeln bei der pH-Berechnung vor und nach dem Äquivalenzpunkt helfen?
1 Antwort
Klar, kann man. Hydrogencarbonat hat ja noch ein acides Proton, welches mit dem OH⁻ der Lauge zu Wasser neutralisiert werden kann. https://images.gutefrage.net/media/fragen/bilder/titrationskurve-mehrprotonige-saeuren-kohlensaeure/0_big.jpg?v=1448823484000
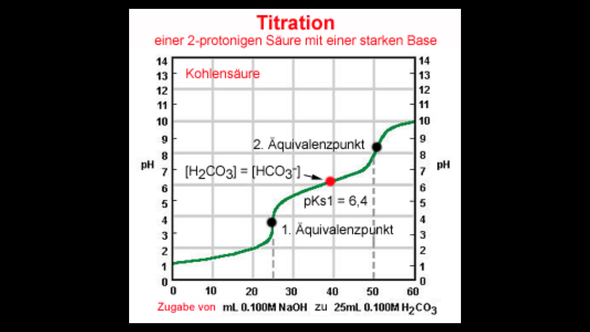

Welche Formeln? Meinst Du die Reaktionsgleichung für die Neutralisation?
1. CO2(aq) + Na⁺(aq) + 2 OH⁻(aq) ↔ HCO3 ̄(aq) + Na⁺(aq) + H2O(l)
2. HCO3 ̄(aq) + Na⁺(aq) + OH⁻(aq) ↔ CO3²⁻(aq) + Na⁺(aq) + H2O(l)
(aq) = aqueous = in Wasser gelöst
(l) = liquid = flüssig
hmm ne ich meine die Formeln die man zu Berechnung des pH-Wertes braucht. Also, am Anfang, vor ÄP, im ÄP und so weiter. Kannst du mir damit helfen?
Am Anfang hat es eine wässrige Lösung von NaHCO3 . Der pH-Wert der schwachen Base HCO3 ̄ berechnet sich nach:
pH = 14 - 1/2(pKb - log co) mit pKb = 14 - pKs1 = 6,35
pH = 8,7
Wenn nun NaOH zugefügt wird, entsteht ein Puffersystem aus HCO3 ̄ und CO3²⁻. Das kann man mit der Henderson-Hasselbalch-Gleichung rechnen.
pH = pKs2 + log([CO3 ̄]/[HCO3 ̄])
Bei einem symmetrischen Puffer [CO3 ̄] = [HCO3 ̄] gilt pH = pKs2 = 10,33
Wenn alles zu Na2CO3 umgesetzt ist, kann man wieder mit der ersten Gleichung und dem pks2 = 10,33 rechnen.
Danach muss man nur noch die überschüssige NaOH-Konzentration rechnen.
ja das meinte ich danke, ich glaube du hast einen Fehler bei der ersten Rechnung Pks1 ist gleicht 6,35 und dadurch ist Pkb1 gleich 7,65
danke dir! Hast du noch die Formeln dazu?