Chemie dringend Säure?
Hey. Ich muss bis übermorgen folgende Aufgabe gelöst bekommen und weiß nicht wie man das machen soll: Sie haben 150mL einer 0,1 molaren Salzsäure-Lösung. Welchen pH-Wert erhalten Sie, wenn Sie zu der Salzsäure-Lösung 100mL NaOH (0,2 M) hinzugeben?
Schnelle Hilfe gesucht,
4 Antworten
Um den pH-Wert der Salzsäure-Lösung zu berechnen, müssen wir die Konzentration der Salzsäure-Lösung kennen. Da Sie 150 mL einer 0,1 molaren Salzsäure-Lösung haben, können wir die Konzentration wie folgt berechnen:
c = n / V
c = 0,1 mol / (150 mL / 1000)
c = 0,00067 mol/L
Wenn Sie 100 mL einer 0,2 M NaOH-Lösung hinzufügen, wird die Salzsäure neutralisiert und es entsteht Wasser und Natriumchlorid (NaCl). Die Reaktionsgleichung lautet:
HCl + NaOH → NaCl + H2O
Da NaOH eine starke Base ist, wird sie vollständig dissoziiert und es entsteht OH- Ionen. Die Anzahl der OH- Ionen kann wie folgt berechnet werden:
n(OH-) = c(NaOH) * V(NaOH)
n(OH-) = 0,2 mol/L * (100 mL / 1000)
n(OH-) = 0,02 mol
Da die Anzahl der OH- Ionen gleich der Anzahl der H+ Ionen ist (da die Säure und Base im Verhältnis 1:1 reagieren), können wir den pH-Wert wie folgt berechnen:
pH = -log([H+])
pH = -log(0,02 mol)
pH = 1,7
Daher beträgt der pH-Wert der Lösung nach Zugabe von NaOH etwa 1,712. Ich hoffe das hilft!
Ja danke hab ich im Endeffekt auch gemerkt dann
hey danke für die schnelle Hilfe. Ja hat mir sehr geholfen!
Hätte tatsächlich nur noch dann eine kurze Frage bezüglich einer anderen Aufgabe wo man eine Strukturformel benennen soll. ich lade sofort ein Foto hoch mit meiner Idee aber wäre nett, wenn Sie mir da nochmal sagen können ob das richtig ist
150 mL einer 0,1 molaren HCl sind:
n(HCl) = c * V = 0,1 mol/L * 0,150 L = 0,015 mol
100 mL einer 0,2 molaren NaOH sind:
n(NaOH) = 0,2 mol/L * 0,10 L = 0,020 mol
V(gesamt) = 0,250 L
Die HCl wird also von dem Überschuss an NaOH vollständig zu NaCl und Wasser neutralisiert. Es bleibt die Stoffmenge n(Rest) an NaOH zurück.
n(Rest) = 0,020 mol - 0,015 mol = 0,005 mol NaOH
Die befinden sich in 250 mL Lösung.
c = n/V = 0,005 mol/0,250 L = 0,02 mol/L
pOH = -log[OH⁻] = 1,7
pH = 14 - pOH = 12,3
Berechne die Stoffmengen, bilde die Differenz an verbleibender Natronlauge, bilde das Gesamtvolumen und berechne die Konzentration. Daraus kannst du über den Logarithmus den pH ermitteln.
Hey das ist die Strukturformel. Geht iwie nur so gerade als eigene Antwort aber ja.
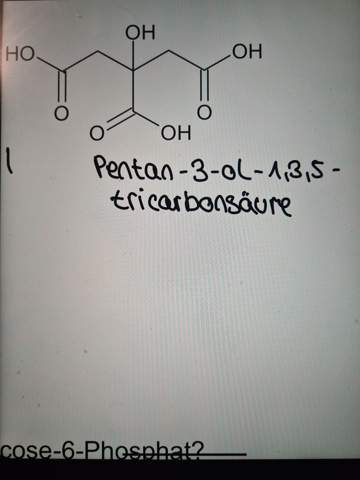
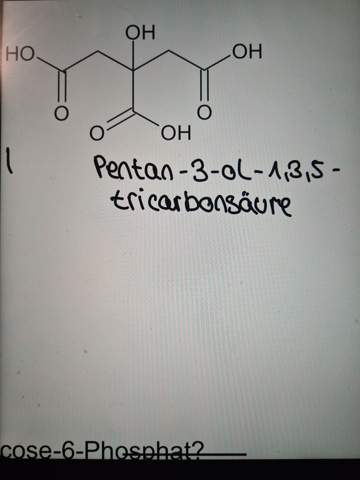
Das ist völlig zusammenhalluzinierter Stuss.