Allosterische Hemmung?
Warum bewirkt eine Erhöhung der Substratkonzentration keine Erhöhung der Enzymaktivität/Reaktionsgeschwindigkeit bei der allosterischen Hemmung?
1 Antwort
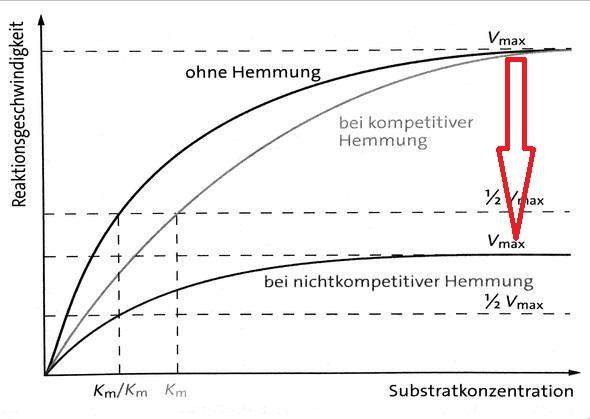
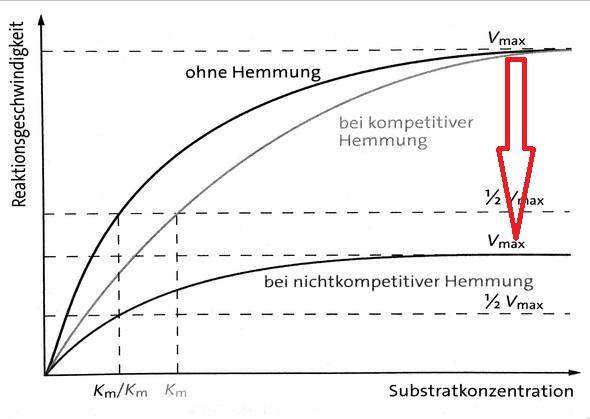
eine Verbindung, die einem Substrat sehr ähnlich ist, wird zwar an das Enzym gebunden, aber nicht umgesetzt. Solange sie an das Enzym bindet, ist es für andere Substrate unzugänglich und kann solange auch nicht wirken. Die Hemmung kommt durch eine mit dem Substrat um die gleiche Bindungsstelle (aktives Zentrum) konkurrierende Verbindung zustande. Ein solcher Inhibitor wirkt "kompetitiv", die beiden wettstreiten um die Bindung am Enzym. Ein Graph einer Messung bei steigender Substratkonzentration einer kompetitiv gehemmten Reaktion würde zeigen, dass die Reaktionsgeschwindigkeit der Enzyme vermindert wird, jedoch mit zunehmender Substratkonzentration (x-Achse), die maximale Umsatzgeschwindikeit der Enzyme (Vmax) erreicht würde (die Kurven treffen sich irgendwann bei Vmax). Schauen wir uns das einmal an:
Bildquelle: gemeinfrei
Der mittlere Graph zeigt ein charakteristisches Verhalten bei kompetitiven Hemmstoffen. Wenn viel mehr Substratmoleküle, mit vergleichsweise wenigen Inhibitormolekülen, um die gleiche Bindungstelle am Enzym konkurrieren, "gewinnt" irgendwann das Substrat. Das bedeutet, eine kompetitive Hemmung kann mit steigender Substratkonzentration aufgehoben werden.
Eine Verbindung, die durch Bindung an ein Enzym, seine Aktivität herabsetzt, indem es an eine andere Bindungsstelle bindet, als das Substrat, hemmt das Enzym "nichtkompetitiv", wie es ein allosterischer Inhibitor vermag. Substrat und Inhibitor konkurrieren nicht miteinander um die gleiche Bindungsstelle, denn sie besetzen zwei unterschiedliche Bindungsstellen am Enzym. Ein nichtkompetitiver (allosterischer) Inhibitor verhindert, dass Produkte gebildet werden, solange er am Enzym gebunden ist. Er kann nicht durch steigende Substratkonzentrationen von seiner Bindungsstelle verdrängt werden.
Der untere Graph der nichtkompetitiv gehemmten Reaktion zeigt, dass die Reaktionsgeschwindigkeit der Enzyme durch den Inhibitor vermindert wird und auch mit zunehmnder Substratkonzentration (x-Achse), die maximale Umsatzgeschwindikeit der Enzyme nicht mehr erreicht wird (die Kurve bleibt deutlich unter der ungehemmten Reaktion zurück). Das ist ein typisches Verhalten bei nichtkompetitiven Hemmstoffen, dass Vmax, auch bei hohen Subtratkonzentrationen, nicht mehr erreicht wird. LG