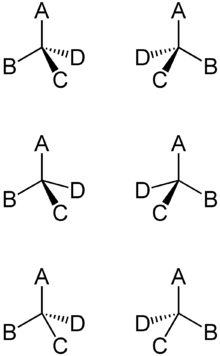
Ist es richtig, dass egal wie man hier ABCD anordnet, immer Diastereomere dabei rauskommen (außer bei den Enantiomerenpaaren) (Bild ganz unten)?
Und wenn man statt ABCD sagen wir 2 Mal D benutzt, also ABC und 2x D benutzt, dann kommen dabei genauso unterschiedliche Diastereomere raus (außer dem Enantiomerpaar), richtig?
Ich frag das alles nur, weil ich mir sicher sein will, dass ich die Definition von Diastereomeren in der Praxis richtig anwende.
Ich weiß, dass alle Konfigurationsisomere, die keine Enantiomere sind, Diastereomere sind.
2 Antworten

Diastereomere gibt es nur, wenn in einem Molekül mehr als ein chirales C vorkommt. Bei der Darstellung von nur einem C mit 4 Substituenten unbekannter Art, gibt es daher keine. Es gibt nur eine identische und eine nicht identische Konfiguration am C, nämlich R und S. Dabei sind die R- und S-Moleküle enatiomer zueinander, also wie Bild und Spiegelbild. Alle 3 Darstellungen in einer Reihe zeigen dieselbe Molekülgeometrie.

Aber wenn ich bei dem Molekül in der Grafik nur als Beispiel A und B vertausche erhalte ich doch einen Isomer oder nicht?
Ja, egal welche beiden man vertauscht, erhält man das spiegelbildliche Molekül. Es gibt nur 2 Isomere davon, R und S, egal, was mit was getauscht wird. Mache ein Model, das kann man immer so drehen, dass entweder das R- oder S-Molekül dabei raus kommt. Keine 4 Isomere!

Immer noch nicht.

Was meinst du? Hier hat jemand kommentiert "Das ist korrekt."
Jetzt bin ich verwirrt. Sehe ich das so richtig oder nicht?

Oder warst das nicht du?
Wenn Experten keine Lust mehr haben, auf die immer gleichen Fragen zu antworten, dann bleiben halt die Spontanexperten, die falsche Antworten geben.



Okay, ich versteh glaub ich was du meinst.
Also ich kann nicht beliebig anordnen.... Okay...
Aber gehen wir einfach mal davon aus, dass diese unterschiedlichen Anordnungen jetzt einfach existieren würden, die ich oben beschreibe.
Dann wären das bis auf die Enantiomerenpaare die möglich sind alles Diastereomere, oder nicht?
Es sind Diastereomere aus meiner Sicht, weil ja so wie ich es verstehe die Konstitutuion (Reihenfolge) immer dieselbe ist, da ja immer dieselben Atome an dem Kohlenstoff-Atom angebracht werden, sich nur ihre Position der Anbringung am Kohlenstoff-Atom unterscheidet, also es eigentlich nur ein Unterschied der räumlichen Anordnung ist. Somit sind es keine Konstitutionsisomere sondern Konfigurationsisomere.
Find das gar nicht sooooo leicht zu verstehen, weil auch wenn man nur die Anordnung an einem Kohlenstoffatom verändert, könnte man das ja als Veränderung einer Reihenfolge interpretieren und Veränderungen der Reihenfolge sind in der Chemie dann aber eigentlich Konstitutionsisomere.
Das was ich oben beschrieben habe sind aber alles nur Konfigurationsisomere schätze ich.
Konstitutionsisomere hat man z.B. dann wenn man bei mehreren verknüpften Kohlenstoffatomen, die Positionen der Kohlenstoffatome oder von Substituenten an den Kohlenstoff-Atomen ändert.
Versteh ich das alles einigermaßen richtig?

Es gibt keine Schraubzwingen, mit denen du Moleküle dazu bringen kannst, dass der Bindungswinkel beispielsweise 97 statt 109 ° ist.
Wenn es sie gäbe, dann bräuchten wir ein komplett neues Arsenal an Fachbegriffen.
Ich kann nur meinen Rat wiederholen, dir einen Molekülbaukasten zuzulegen. Sich das alles räumlich vorzustellen ist wirklich nicht einfach. Ich hab ja mal Chemie studiert und krieg trotzdem bei Kohlenhydrat-Fragen regelmäßig die Krise.
Aber wenn ich bei dem Molekül in der Grafik nur als Beispiel A und B vertausche erhalte ich doch einen Isomer oder nicht? Einen Konfigurationsisomer?
Glaub es müsste vier verschiedene Anordnung bei dem Molekül aus der Grafik geben theoretisch, wenn man ABCD anders anordnet. Also 4 Isomere?
Die Konstitution (Reihenfolge) ist nach meinem Verständnis bei jeder Anordnung der Atome ABCD dieselbe, nur die räumliche Anordnung ist unterschiedlich, man kann die verschiedenen Moleküle auch nur durch Brechen und Neuverknüpfen von Bindungen ineinander umwandeln, sodass keine Fonformationsisomerie vorliegt, sondern stattdessen Konfigurationsisomerie.
Ist das nicht richtig was ich schreib?