Wie leitet man das Ionenprodukt her?
hallo,
ich versteh nicht so ganz, wie das ionenprodukt von wasser hergeleitet wird.
ich brauche keine super wissenschaftliche erklärung, ich studiere kein chemie, aber mal so in den grundzügen wär nett.
lg
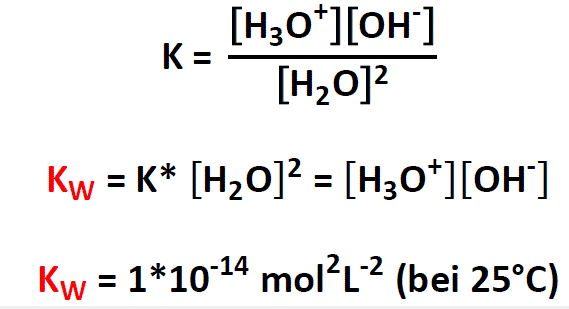
2 Antworten

Das kommt aus dem Massenwirkungsgesetz. Jede chemische Reaktion hat eine Gleichgewichtskonstante, die ist einfach das Produkt (im mathematischen Sinn) der Produkte (im chemischen Sinn) durch das Produkt der Edukte.
A + B ⟶ C + D K = c(C)·c(D) / (c(A)·c(B))
Dieser Wert K hat für jede Reaktion einen fixen Wert (abhängig nur von Temperatur und Druck). Egal wieviel A,B,C,D Du in den Topf wirfst, die Reaktion läuft dann immer genau so weit ab, daß die Konzentrationen im Gleichgewicht den festen Wert von K ergeben.
(Ja, statt der Konzentration c sollte man eigentlich die Aktivität a verwenden, aber das ist in der Praxis kompliziert, und mit Konzentrationen stimmt es immer noch näherungsweise)
Wasser zeigt jetzt die Autoprotolyse
2 H₂O ⟶ H₃O⁺ + OH⁻
und dafür kann ich natürlich auch eine Gleichgewichtskonstante formulieren
K = c(H₃O⁺) · c(OH⁻) / c²(H₂O)
(hier brauchen wir ein Quadrat, weil ja 2 H₂O dasselbe wie H₂O + H₂O ist)
und weil die Konzentration von Wasser in verdünnten Lösungen ja immer dieselbe ist (nämlich 55.5 mol/l), kann man sie zur Konstante dazuschreiben
K·c²(H₂O) = Kw = c(H₃O⁺) · c(OH⁻)
und damit haben wir das Resultat: Das Produkt der Konzentrationen von H₃O⁺ und OH⁻ hat einen festen Wert, der unabhängig davon ist, was sonst noch alles in der Suppe herumschwimmt. Und freundlicherweise hat dieses Produkt auch noch einen simplen Zahlenwert Kw=10⁻¹⁴ mol²/l²
Jetzt bleibt noch die Frage, wo eigentlich das Massenwirkungsgesetz herkommt. Das kann man aus der statistischen Thermodynamik ableiten, aber vermutlich willst Du nicht wissen, wie das geht. Es braucht ziemlich fortgeschrittene Konzepte, um diese Ableitung zu verstehen. Besser, Du glaubst es.
Manche Leute werden Dir eine simple Ableitung des Massenwirkungsgesetzes über Reaktionsgeschwindigkeiten anbieten. Die ist nicht falsch, läßt aber viele Fragen offen, wenn die Reaktionsmechanismen komplizierter werden (ich sehe z.B.nicht, wie man sie für Radikalkettenreaktionen rechtfertigen kann, oder wie man damit erklären kann, daß ein Katalysator das Gleichgewicht nicht verschiebt). Ich halte sie nicht für wirklich erhellend, deshalb biete ich sie Dir gar nicht erst an.

Das Ionenprodukt ist eine spezielle Form des Massenwirkungsgesetzes, bei der die Gleichgewichtskonzentration von Wasser ([H₂O] = 55,55 mol/L) als konstant angenommen und in die Gleichgewichtskonstante K_w mit einbezogen wird. Da nur ein sehr geringer Teil des Wassers protolysiert (bei 22°C nur etwa 0,00000036%), ist das erlaubt.
=> K_w = K*[55,55]² = [10⁻⁷][10⁻⁷] = 10⁻¹⁴ mol²/L²