Wie gehe ich bei der Bestimmung der Aminosäuren der Peptide vor, ich bin hilflos?
2 Antworten
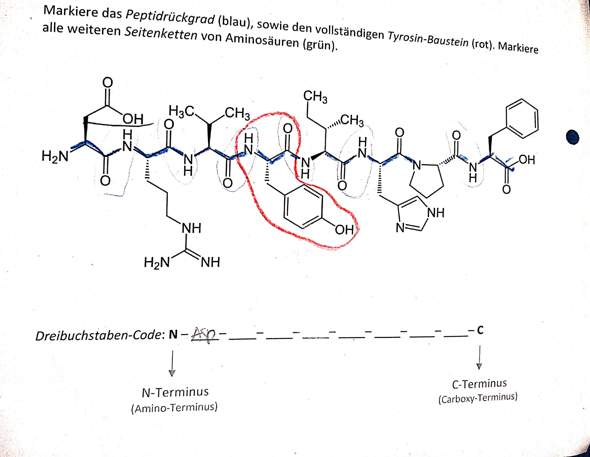
Das Peptidrückgrat (das man übrigens mit t schreibt) und auch den Tyrosin-Baustein hast du ja richtig bestimmt. Du scheinst also zu wissen, wie man sich orientiert.
Ansonsten muss man halt wissen, wie die einzelnen Aminosäuren aussehen. Hilfreich ist die Erkenntnis, dass die Seitenketten immer einen fetten oder einen gestrichelten Keil haben (bei Pro manchmal nicht dargestellt). Das breite Ende vom Keil ist das 3. C-Atom der freien Aminosäure (von der Carboxy-Gruppe aus gezählt). Damit kann man Verwechslungen wie Glu/Asp, Gln/Asn, Leu/Val vorbeugen. Die erste Aminosäure ist korrekt als Asparaginsäure identifiziert.
Prolin ist besonders einfach zu erkennen, da hier die Seitenkette mit dem Stickstoff des Rückgrats verbunden ist, entsprechend fehlt dort der Wasserstoff. Prolin kommt auch in diesem Beispiel vor.
Arginin wird sofort durch die Guanidin-Gruppe verraten. Trotzdem sollte man die C-Atome nachzählen. Allgemein sind die grösseren Aminosäuren und solche mit Ringen einfacher zu erkennen, weil sie recht charakteristisch aussehen.
Glycin ist daran zu erkennen, dass das Rückgrat dort "nackt" aussieht, nämlich weil die freie Aminosäure gar kein 3. C-Atom hat, das am Ende eines Keils stehen könnte.
Es kann auch hilfreich sein, Peptide mal selber zu zeichnen, um sich besser "eindenken" zu können. Z.B. kann man mit dem Einbuchstabencode Wörter schreiben. Wir korrigieren es gerne.
LG, TheGuyOfReason
Wenn man vom N-terminalen Ende anfängt, schneidet man gedanklich immer das Carbonyl-C, also welches doppelt an O gebunden ist, vom rechts gebundenen -NH ab. Dann kommt an das abgeschnittene -C=O eine OH.Gruppe und an das abgeschnittene N ein zusätzliches H. Das Tyrosin mit der roten Einkreisung ist schon richtig an den genannten Stellen geschnitten und markiert.