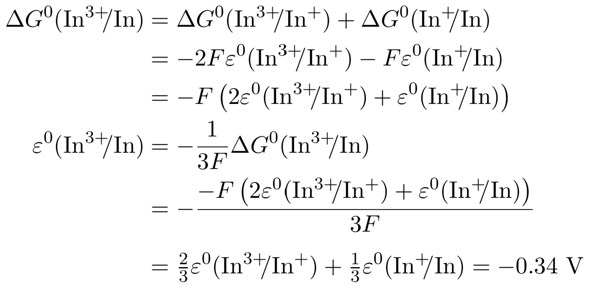Reduktionspotential?
Hey an Alle,
Könnt ihr mir sagen, ob ich diese Aufgabe richtig gelöst hatte?


1 Antwort
Au³⁺ + 3 Li ⟶ Au + 3 Li³⁺
Für die erwartete Spannung (bei c=1 mol/l, also Standard) ist einfach
ΔE⁰=1.42+3.04=4.46 V
ich weiß nicht, wo Du Deine Zahlen hernimmst, in der Angabe stehen sie nicht so.
Nun zum schwierigeren Beispiel mit dem Indium:
In³⁺ + 2 e¯ ⟶ In⁺ ε⁰=−0.40 V
In⁺ + e¯ ⟶ In ε⁰=−0.23 V
Wikipedia gibt ε⁰(In³⁺/In⁺)=0.444 V und ε⁰(In⁺/In)=−0.126 V an. Ich habe keine Ahnung, was stimmt, und rechne mit Deinen Zahlen weiter.
Aus diesen beiden Potentialen sollen wir ε⁰(In³⁺/In) ausrechnen, also das Potential für die Reaktion
In³⁺ + e¯ ⟶ In
und man sieht natürlich sofort, daß diese Reaktion die Summe der beiden Reaktionen oben ist. Wenn Du nicht weißt, wie man da vorgeht, dann machst Du am besten den Umweg über die ΔG-Werte, denn von denen wissen wir ja, daß sie sich für zusammengesetzte Reaktionen addieren (Hessscher Satz oder so ähnlich, es sind ja Zustandsfunktionen). Der nötige Zusammenhang ist ΔG=−zFε, wobei z die Anzahl der ausgetauschten Elektronen ist und F=96485 C/mol die Faraday-Konstante, die Ladung von einem Mol Elektronen (die wird sich allerdings letztlich herauskürzen).
Es gilt also ΔG(In³⁺/In) = ΔG(In³⁺/In⁺) + ΔG(In⁺/In), und das dröseln wir jetzt auf:

(in der drittletzten Zeile habe ich einfach ΔG=−zFε für die Gesamtreaktion nach ε aufgelöst und dann das zuvor erhaltene Ergebnis von ΔG eingesetzt)
Du kannst Dir also aus diesem Beispiel merken, daß Standardreduktionspotentiale beim Addieren von Reaktionen mit den Elektronenzahlen gewichtet werden müssen. Das liegt im wesentlichen daran, daß Potentiale so etwas wie Energie pro Elektron sind.