Redoxreaktionen Reaktionsgleichungen?
Ich verstehe meine Chemie HA nicht ganz,es geht um Redoxreaktionen die Aufgabe lautet:
Geben sie begründet an, bei welchen Paarungen eine Reaktion eintritt und geben Sie in diesem Fall die Reaktionsgleichung an(alle nicht angegebenen Metalle sind zweiwertig)
Es gibt ein Beispiel für Blei in Kupfersulfatlösung:Das Reduktionsvermögen von Cu ist größer als von Pb, daher findet eine Reaktion statt:Pb-> Pb2+ +2e- |*1Cu2+ + 2e- -> Cu |*1Pb+ Cu2+ -> Pb2+ + Cu
Das Problem ist, ich verstehe überhaupt nicht was hier gemacht wird.Woher kommen die zahlen?Warum muss ich alles *1 nehmen?Ich habe 4 aufgaben dazu:a) Chrom in Nickelsulfatlösung(Cr ist 3wertig)b) Zinn in Aluminiumchloridlösung(Al ist 3wertig)c) Blei in Silberbromidlösung(Ag ist 3wertig)d) Eisen in Magnesiumchlorid
Kann mir bitte jemand erklären was ich hier machen muss?
2 Antworten

Anmerkung:
c) Blei in Silberbromidlösung(Ag ist 3wertig)
Das Ag ist nicht drei- sondern einwertig.
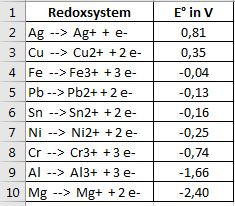
Ich habe Dir in einer Exceldatei die Redoxsysteme aufgelistet, die Du in der elektrochemischen Spannungsreihe (Eingabe bei google oder einer Nachschau im Chemielehrbuch) suchen musst.
Zunächst eine Vorbemerkung: Die Aufgaben wurden Dir so gestellt, dass die Anionen keine Rolle spielen. Deshalb werden sie auch nicht geschrieben. Bei vielen Redoxreaktionen spielen sie aber sehr wohl eine Rolle. Es wird leider noch komplizierter.
Als Lösungsbeispiel zeige ich Dir die von Aufgabe c):
Das Redoxsystem von Blei hat das kleinere E° als das von Silber. Das Redoxsystem mit dem kleineren E° wird immer oxidiert im Vergleich zu dem mit größerem E°. Dieses System wird reduziert.
Die Voraussetzung ist natürlich immer die, dass das System, das reduziert werden soll, im oxidierten Zustand vorliegt und das, welches oxidiert werden soll, im reduzierten Zustand vorliegt. Das ist hier bei beiden der Fall.
Oxidation: Pb --> Pb²⁺ + 2 e⁻
Reduktion: Ag⁺ + e⁻--> Ag
Diese beiden Reaktionen werden zur Redoxreaktion zusammengefasst, wobei die Elektronen nicht geschrieben werden. Mithilfe der Koeffizienten müssen die unterschiedlichen Elektronenzahlen ausgeglichen werden.
Redoxreaktion: 2 Ag⁺ + Pb --> 2 Ag + Pb²⁺
In entsprechender Weise musst Du bei den anderen Aufgaben vorgehen.

Du musst die Redoxpotentiale vergleichen bzw. die Elektromotorische Kraft (EMK) berechnen und das Vorzeichen anschauen.
1Cu +2 + 2e- => 1Cu = Cu +2 + 2e- => Cu


Tut mir leid, aber sie haben in der Antwort genau das selbe was im Beispiel schon steht geschrieben, was mir nicht weiterhilft.Trotz des artikels ist mir nicht bewusst wie ich die aufgabe löse.

Pb +2 + 2e- <=> Pb E0=-0,13V Anode
Cu +2 + 2e-<=> Cu E0=+0,52V Kathode
EMK=Delta E= E(Kathode)-E(Anode)=0,39V (bzw. E(red)-E(Ox))
Bei einem Wert größer 0 läuft die Reaktion ab.
Normalerweise rechnet man noch die Konzentrationen ein, jedoch sind diese nicht angegeben.

wie wäre es den dann bei aufgabe a z.b.? Ist Cr->Cr3+ +2e- |*3 Ni2+ +2e- -> Ni |*3 Cr+Ni2+ -> Cr3+ + Ni richtig?

Wäre echt nett wenn sie für mich die 4 aufgaben berechnen, also die gleichung machen.vllt kann ich das dann besser verstehen.

Ich habe mir die Aufgabe nochmal angeguckt und glaube ich habe es fast verstanden:
2Cr + 3NiSO4-> Cr2(SO4)3 +3Ni
Dabei geht Cr von der Oxidationszahl 0 zu +3 über und Ni von +2 zu 0.
Deswegen war meine Lösung nun:
Cr->Cr3+ +3e- |*2
Ni2+ +2e- -> Ni |*3
2Cr+3Ni2+ -> 2Cr3+ +3Ni
ist das richtig?
Für b) wäre keine Reaktion möglich, da Sn ein größeres Reduktionsvermögen als Al hat?
Für c) habe ich mich verschrieben, Ag ist einwertig heißt:
Pb + AgBr-> PbBr +Ag
Pb -> Pb+ + e- |*1
Ag+ + e- -> Ag |*1
Pb+ Ag+ -> Pb+ + Ag
Für d) wie bei b) keine Reaktion da Fe ein größeres Reduktionsvermögen hat als Mg?

a) richtig
b) richtig
c)
Pb => Pb +2 + 2e-
Ag+ + e- => Ag
Pb + 2 Ag+ => 2Ag + Pb +2
d) richtig
Den Begriff der EMK höre ich zum ersten mal und weiß auch nicht wie ich das berechne =(