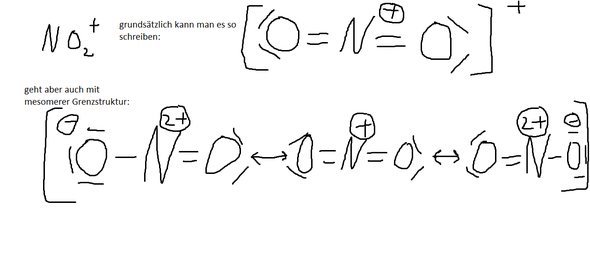Lewisschreibweise-Chemie?
Hallo, ich schreibe morgen in der Schule einen Chemietest über die Lewisschreibweise und habe noch eine Frage: Wie man die Bindungen in dieser Form darstellt habe ich grundsätzlich verstanden. In der letzten Stunde haben wir uns allerdings eine neue "Bedingung" angeschaut. Die Beispielformel war NO2+ (sorry, ich weiß nicht, wie man tief- oder hochgestellte Zahlen schreibt...). Jedenfalls bedeutet diese Formel ja, dass das Stickstoffmolekül eine positive Ladung und damit nicht fünf sondern nur vier Außenelektronen vorhanden sind. Woher weiß man jetzt aber, dass es um den Sickstoff und nicht um den Sauerstoff geht und wie ist das bei anderen Verbindungen? Wird einfach immer ein Elektron abgezogen um eine positive Ladung zu erhalten? Ich hoffe, die Frage ist verständlich formuliert und ihr könnt mir ganz schnell helfen. LG, Katie
Kleiner Anhang: Falls jemand antwortet- Ich bin jetzt in der achten Klasse und das ist erst mein zweites Chemie- Lernjahr. Vielleicht könntet ihr es also so einfach wie möglich erklären :)
2 Antworten
Hi,
mir ist nicht ganz klar, ob ich deine Frage richtig verstanden habe, aber O ist der elektronegativere Partner und zieht damit das Elektron zu sich. Dadurch ist die Formalladung beim O dann negativ und beim N positiv.
Für so einen Fall mit positiver Formalladung kannst du ein paar Beispiele als Bilder googeln.
m.f.G.
anwesende
Sauerstoff hat eine sehr große Elektronegativität weshalb es praktisch nie dazu kommt das es Valenzelektronen abgezogen bekommt ( Außer wenn es mit Fluor reagiert ). Deshalb kann man sich merken das der Sauerstoff immer eine Einfachbindung und 3 frei Elektronenpaare hat ( es ist dann einfach negativ ) oder eine Doppelbindung und zwei freie Elektronenpaare hat.
Habe mal fix was bei Paint gekritzelt hoffe das es so ausreichend ist.