Chemie wie klappt das?

Thema: Atome Bilden ionen...
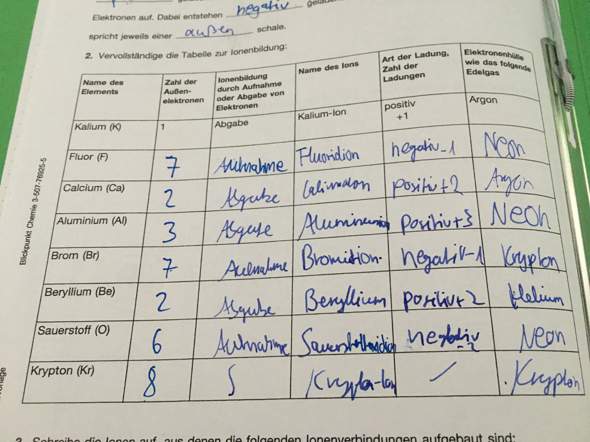
habe es in der Schule ausgefüllt da es der Lehrer an die tafel geschrieben hat...
Nun schreiben wir auch morgen darüber eine Hü, jedoch verstehe ich Null wirklich garnichts... Könnte mir das bitte einer erklären von vorne bis hinten
Vielen herzlichen dank an jeden der mir hilft...
1 Antwort
Hallo farouksala72
die Edelgaskonfiguration bei Helium mit 2, bei den anderen Edelgasen mit 8 Außenelektronen ist ein besonders stabiler Zustand, was sich ja auch in dem Charakter der reaktionsträgen einatomigen Edelgase bemerkbar macht.
Die anderen Elemente versuchen, in Verbindungen genau diese Edelgaskonfiguration zu erreichen. Das gelingt dadurch, dass sie Valenzelektronen abgeben oder aufnehmen.
Betrachtet man nur die Hauptgruppen (HG), so haben die Alkalimetalle in der 1. HG nur ein Außenelektron, die Erdalkalimetalle in der 2. HG nur 2 Außenelektronen. Geben sie diese ab, erhalten sie dadurch die Edelgaskonfiguration. Aus den ungeladenen Atomen werden dann die einfach positiv geladene Kationen wie Na⁺ bzw zweifach positiv geladene Kationen wie z.B. Ca²⁺.
Ähnlich sieht es mit den Halogenen in der 7. HG aus. Ihnen genügt es, ein einziges Elektron aufzunehmen, um ebenfalls diese Edelgaskonfiguration zu erreichen. Aus dem gleichen Grund nimmt Sauerstoff in der 6. HG zwei Elektronen, Stickstoff in der 5. HG drei Elektronen auf. Hierdurch entstehen 1-fach, 2-fach und 3-fach negativ geladene Ionen wie Br⁻, O²⁻ und N³⁻
Diese zahlenmäßige Aufnahme und Angabe von Elektronen deckt sich mit dem (veralteten) Begriff Wertigkeit.
HG 1 und HG 7: einwertig, z.B. Na⁺ und Br⁻
HG 2 und HG 6: zweiwertig, z.B. Mg²⁺ und S²⁻
HG3 und HG 5: dreiwertig, z.B. Al³⁺ und N³⁻
HG 4: vierwertig
Will man nun diese Ionen zu einer ungeladenen Verbindung kombinieren, muss man darauf achten, dass sich die Ladungen zu 'Null' ausgleichen. Hierzu ein paar Beispiele:
2 Na⁺ + O²⁻ → Na₂O
Mg²⁺ + 2 Br⁻ → MgBr₂
Al³⁺ + N³⁻ → AlN
3 Li⁺ + P³⁻ → Li₃P
2 Al³⁺ + 3 O²⁻ → Al₂O₃
LG