Biologie klasse 11?
Meine Frage ist Nummer 2 und steht bei dem beigefügten Bild dabei, ich weiß damit nichts anzufangen..
4 Antworten

Moin,
In der Chemie versteht man unter einem Katalysator einen Stoff, der die Aktivierungsenergie einer chemischen Reaktion herabsetzt und diese somit leichter erfolgen kann.
Der Katalysator kann an einer Umsetzung zunächst beteiligt sein, aber am Ende der Reaktion liegt er unverändert vor.
Ein Katalysator sorgt bei einer Gleichgewichtsreaktion dafür, dass sich das Gleichgewicht schneller einstellt. Der Katalysator hat aber keinen Einfluss auf die Lage des Gleichgewichts, weil er Hin- und Rückreaktion gleichermaßen fördert.
Enzyme sind sogenannte "Biokatalysatoren". Auch sie beschleunigen chemische Umbauprozesse, indem sie die Aktivierungsenergie einer chemischen Reaktion herabsetzen. Auch sie liegen nach einer chemischen Umsetzung unverändert vor.
Aber Enzyme sind in der Regel substratspezifisch und stereoselektiv. Das heißt, anders als chemische Katalysatoren setzen sie ein Substrat nur in eine Richtung um. Bei bestimmter Stereoisomerie setzen sie außerdem nicht immer alle Isomere um, sondern nur "passende".
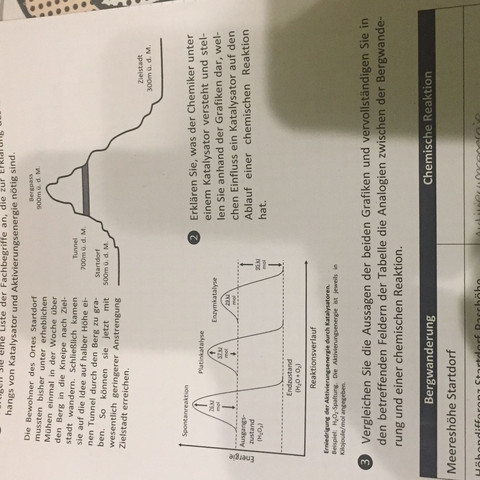
Was nun die Graphik angeht, so zeigt sie die Wirkung auf die Zersetzung von Wasserstoffperoxid.
2 H2O2 ---> 2 H2O + O2
Wie man anhand der Reaktionsgleichung sehen kann, erfolgt die Spaltung, wenn zwei Moleküle Wasserstoffperoxid zusammenprallen und miteinander reagieren. Dazu müssen die Moleküle nicht nur eine gewisse Bewegungsenergie haben, sondern auch im richtigen Winkel zusammenstoßen.
Die erste Kurve in der Graphik zeigt nun, das Wasserstoffperoxid auch "spontan" in Wasser und Sauerstoff zerfällt, wenn eine gewisse Aktivierungsenergie vorhanden ist. Die Aktivierungsenergie sorgt im Grunde dafür, dass sich die Moleküle schnell genug bewegen und so auch ab und zu im richtigen Winkel aufeinander prallen.
Die zweite Kurve zeigt, dass dieser Vorgang mit weniger Aktivierungsenergie vonstatten geht, wenn Platin als Katalysator eingesetzt wird. Das Metall bietet nämlich an seiner Oberfläche Anlagerungsstellen, die das Wasserstoffperoxid so ausrichten, dass für die Spaltung günstige Zusammenstöße öfter erfolgen können. Somit passieren die Zusammenstöße auch öfter als beim spontanen Zerfall, so dass es insgesamt weniger Aktivierungsenergie braucht, damit es zum Zerfall kommt.
Wasserstoffperoxid (H2O2) ist ein zellschädigender Stoff, weil er ein Oxidationsmittel ist und somit Zellorganellen oder Strukturen oxidieren kann, die dann funktionsuntüchtig werden. Das heißt, wenn dieser Stoff in Zellen bei Stoffwechselvorgängen entsteht, ist es günstig für Zellen, wenn sie ihn schnell wieder loswerden könnten, bevor er seine oxidierenden Eigenschaften verwirklichen kann. Deshalb gibt es in Zellen bestimmte Microbodys (Peroxisomen), die genau diese Aufgabe haben, nämlich entstehendes Wasserstoffperoxid abzubauen.
In den Peroxisomen wirken Enzyme, die aktive Zentren haben, in denen sich zwei Moleküle Wasserstoffperoxid so anlagern, dass sie anschließend gespalten werden. Damit erreicht der Biokatalysator eine noch schnellere Umsetzung des Stoffes, weil er nicht nur die Moleküle ausrichtet, sondern auch noch für den Zusammenprall sorgt.
Darum kannst du in der dritten Kurve sehen, dass der Einsatz der Enzyme noch einmal die nötige Aktivierungsenergie herabsetzt.
Alles klar?
LG von der Waterkant

Ein Katalysator setzt die Aktivierungsenergie herab. Das sieht man am Kurvenverlauf. Dein Ausgangsstoff hat irgendeinen Energiewert (obere gestrichelte Linie). Deine Endstoffe (Wasser UND Sauerstoff) haben ZUSAMMEN einen niedrigeren Energiewert (untere gestrichelte Linie). Dazwischen liegen 95 kJ/mol (Information ganz rechts in der Graphik).
In jedem Fall muss man erst einmal Energie aufbringen, damit sich das Wasserstoffperoxid überhaupt umsetzt. Diese Energie, die man da aufbringen muss, bezeichnet man als Aktivierungsenergie.
Ohne Katalysator musst du erst einmal viel Aktivierungsenergie aufbringen (erste Kurve steigt deutlich höher an als die beiden anderen), bevor die Reaktion in gang kommt und dann von alleine zu den Produkten führt (freiwillig ablaufende Reaktion: exotherme Reaktion).
Mit einem Platinkatalysator brauchst du weniger Aktivierungsenergie (Anstieg in Kurve 2 ist nicht ganz so hoch).
Und mit einem Biokatalysator noch weniger (geringste Höhe beim Anstieg der Aktivierungsenergie).
Mit oder ohne Katalysator startet die Reaktion beim gleichen Ausgangsstoff (Wasserstoffperoxid) und am Ende kommen stets auch die gleichen Produkte heraus (Wasser und Sauerstoff). Daran kannst du sehen, dass ein Katalysator keinen Einfluss auf die Ausgangsstoffe oder die Produktpalette hat.
Es werden am Ende auch jedes Mal 95 kJ/mol Energie freigesetzt. Der Katalysator hat also auch keinen Einfluss auf die Reaktionsenergie bzw. darauf, ob es eine exotherme oder eine endotherme Reaktion ist.
Ein Katalysator hat ausschließlich auf die Aktivierungsenergie Einfluss, also auf die Energie, die aufgebracht werden muss, damit die Reaktion überhaupt abläuft.

Hi,
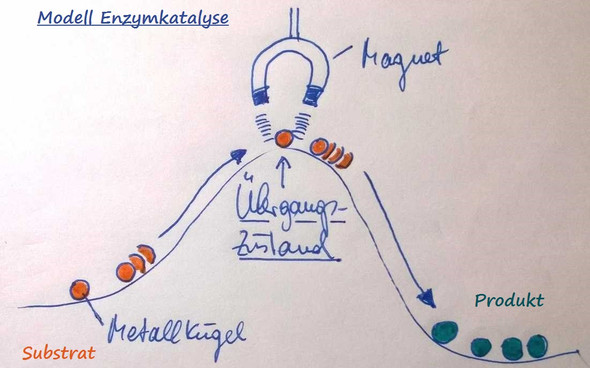
ist schon erklärt worden, ergänzend kannst du die Diagramme mit einem Modell vergleichen (vgl. Skizze unten), wie es das Arbeitsblatt auch versucht.
Du hast links den Ausgangszustand bzw. das Substrat der Enzymreaktion, dann diese (Energie-)barriere ("Aktivierungsenergie") und rechts Produkt der Enzymreaktion.
Wenn man mit Metallkugeln von links nach rechts kommen will, muss man diese erst den Berg hinaufwuchten und dann rollen sie von alleine bergab ins Tal der Produkte. Die Abbildung auf deinem Arbeitsblatt sieht einen "Tunnel" für Bergwanderer vor, um sich den Gang über die Bergkuppe zu ersparen, das ist ähnlich gedacht. In meiner Skizze ist es ein Magnet genau über dem höchsten Punkt, im Unterschied zum "Tunnel" symbolisiert es das, was das Enzym macht: Es stabilisiert den Übergangszustand der Reaktion und ermöglicht so ihren Ablauf unter energetisch günstigeren Bedingungen, so das die Reaktion beschleunigt stattfinden kann. Das Enzym oder der Katalysator selbst geht unverändert aus der Reaktion hervor, es zählt also nur seine Anwesenheit während der Reaktion. Die benötigte Aktivierungsenergie der durch den Katalysator (oder das Enzym) katalysierten Reaktion ist geringer, als die der unkatalysierten Reaktion. Gruß, Cliff

Die Graphik mit dem Vergleich zum Alltagsleben ist doch so schön... Über einen berg zu klettern fällt wesentlich schwerer als durch einen Tunnel zu fahren.
Und eine hohe Aktivierungsenergie zu überwinden fällt viel schwerer, als eine stark verringerte zu überwinden.
Kohlehydrate brennen im Feuer bei Hitze. Da wird der Aktivierungsenergieberg überwunden. Aber durch die Enzyme des Citratzyklus geht dasselbe, die Reaktion mit Sauerstoff zu CO2 und H2O bei Körpertemperatur - und die ist bei einigen Einzellern bei -20°C.

Ein Katalysator ist in der Biologie ein Stoff, welcher den Energieverbrauch einer Reaktion verringert. Das können auch Enzyme sein. Das wichtige dabei ist, dass das Ergebnis der Reaktion sich nicht verändert.
Hey Ja also so verstanden habe ich es aber die Frage: stellen sie anhand der Grafik dar, welchen Einfluss ein Katalysator auf den Ablauf einer chemischen Reaktion hat ist für mich irgendwie noch nicht so ganz klar..😇