Ändert sich die Gleichgewichtskonstante bei Änderung von Druck/Temperatur und Konzentration?
Es hat sich ein Gleichgewicht eingestellt zwischen 2 Reaktionen. Man kann dadurch dann die Gleichgewichtskonstante berechnen. Bei Änderung zb der Temperatur wird die endotherme Reaktion schneller ablaufen. Das bedeutet das Gleichgewicht muss sich verschieben, also kann die Gleichgewichtskonstante nicht konstant sein. Aber in meinem Buch steht die Gleichgewichtskonstante ist konstant, das finde ich etwas verwirrend.
1 Antwort

Die Gleichgewichtskonstanten müssen sich mit der Temperatur ändern, insofern die Reaktion temperaturabhängig ist.
Ich habe dafür ein gutes Beispiel. Es geht um folgende Reaktion:
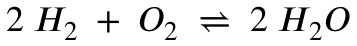
mit den Gleichgewichtskonstanten:
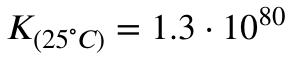
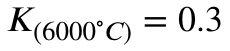
Man kann jetzt interpretieren, dass die Reaktion bei 25 Grad Celsius und einer sooooo hohen Gleichgewichtskonstante stark auf der Produktseite liegen muss (was ja auch stimmt, aus dem Wasserhahn kommt Wasser, kein Gas).
Bei 6000 Grad Celsius liegt das Gleichgewicht jedoch dann eher auf der Eduktseite. Weil Hinreaktion stark exotherm ist, ist die Rückreaktion stark endotherm. Und in dem Fall siehst du, dass dir genau das durch die Gleichgewichtskonstante gezeigt wird.
Mit der Druckabhängigkeit funktioniert es ähnlich.
Bei der Konzentrationsabhängigkeit ist es anders: Hier versucht das System bei einer Konzentrationserhöhung oder -senkung die ursprünglichen Stoffmengenverhältnisse wieder herzustellen, sodass sich die Gleichgewichtskonstante K im Moment der Zugabe oder Abführung der Edukte oder Produkte natürlich ändern würde (da ja für einen Moment andere Konzentrationsverhältnisse vorliegen). Das System reagiert darauf und versucht die ursprünglichen Verhältnisse wiederherzustellen. Entweder werden dann Hin- oder Rückreaktion bevorzugt (Produkt oder Edukt nachgebildet) um wieder den Ausgangszustand zu erreichen. Und da bleibt die Gleichgewichtskonstante (annähernd) konstant.
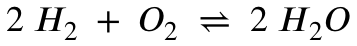
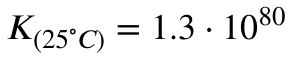
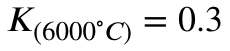

Richtig. Mehr Produkt führt zu mehr Edukt. Tatsächlich wird diese Art Gleichgewichtsabhängigkeit in der Industrie genutzt. Gibt man immer mehr Edukt hinzu, und führt immer mehr Produkt ab, versucht das System immer auf diese Beeinflussung zu reagieren und die ursprünglichen Verhältnisse wiederherzustellen. Es wird also immer neues Produkt nachgebildet.

Danke für ihre Antwort!, also bei Druck und Temperaturänderung verändert sich die Gleichgewichtskonstante permanent weil bestimmte Reaktionen besser ablaufen als andere, und bei Erhöhung der Konzentration stellt sich kurzzeitig eine andere Gleichgewichtskonstante ein, die sich nach einer Zeit weil die Reaktionen mit unterschiedlichen Konzentrationen schneller ablaufen wieder in die alte Ausgangslage zurück gelangen. Kurz: Gebe ich mehr Edukte hinzu, bilden sich mehr Produkte. So habe ich das verstanden, ist diese Annahme richtig? LG