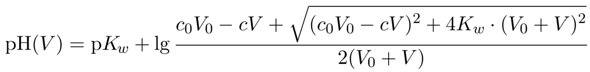Wie löst man diese Aufgabe?
Gegeben: 100ml Natronlauge (0,1 mol/l); Salzsäure (1mol/l)
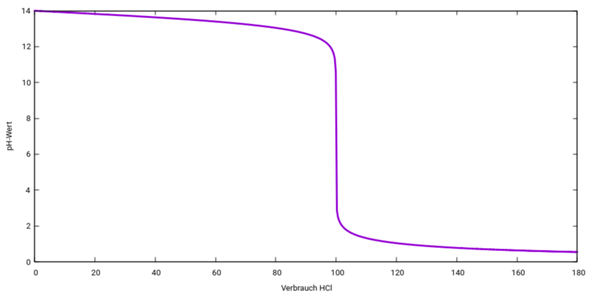
Berechnen Sie markante Punkte und skizzieren Sie den Lauf der Titrationskurve
1 Antwort
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Säuren und Basen, Titration, Chemie
Für diese Aufgabe kann man die Lösung als einfache Funktion angeben:

Dabei sind c₀,V₀ die Konzentration und das Volumen der vorgelegten NaOH (also bei Dir c₀=1 mol/l und V₀=100 ml), c ist die Konzentration der HCl (1 mol/l) und die Formel sagt Dir den pH beim HCl-Verbrauch V:

Du siehst, daß der pH-Wert am Äquivalenzpunkt Vₑ=100 ml einen sehr steilen und hohen Sprung hinlegt.
Wenn man diese schicke Formel nicht kennt, dann muß man mühsam herumrechnen:
- Für V<Vₑ ist die Lösung basisch. Man muß also berechnen, wieviel NaOH in wieviel Volumen sie herumschwimmt und wie hoch ihr pH also ist. Beispiel V=30 ml: Wir haben urprünglich n₀=c₀V₀=0.1 mol NaOH im Kolben und fügen n=cV=0.03 mol HCl hinzu, die ebensoviel NaOH wegfrißt. Es bleiben also n₀−n=0.07 mol NaOH übrig, die in V₀+V=130 ml gelöst sind, die Konzentration ist also 0.538 mol/l und der pH folglich 14+lg(c)=13.73
- Für V>Vₑ ist die Lösung sauer. Man muß also berechnen, wieviel HCl in wieviel Volumen herumschwimmt und wie hoch ihr pH also ist. Beispiel V=130 ml: Zu den ursprünglichen n₀=0.1 mol NaOH kamen n=cV=0.13 mol HCl dazu, es bleiben also 0.03 mol HCl übrig, die in 230 ml gelöst sind, also beträgt die HCl-Konzentration 0.13 mol/l und der pH ist −lg(c)=0.88.
- Leider versagt diese Vorgangsweise in einem schmalen Bereich rund um Vₑ; man kann das beheben, indem man bessere Formeln für den pH-Vert verwendet, nämlich für die HCl pH=−lg[ √(¼c²+Kw)+½c ] und für die NaOH pH=−lg[ √(¼c²+Kw)−½c ]. Diese Formeln bekommt man im Schulunterricht allerdings gewöhnlich nicht zu sehen (dabei ist Kw=10¯¹⁴ mo²/l²).