Welche Farbe leutet Helium denn jetzt?/Woran liegt es dass Helium so viele verschiedene Farben leuchtet?
Hallo, ich bin gerade dabei einen Vortrag für Chemie über die 8. Hauptgruppe zu machen und bin bei dem Element Helium angelangt. Hier stellt sich mir eine Frage: Welche Farbe leuchtet Helium denn jetzt?
Weil überall steht etwas anderes, die eine Quelle sagt gelb/weiß, die andere rosa bis violett. Die Fotos helfen auch nicht weiter, denn sie bestätigen nur die wirren Aussagen. Wenn Helium in so vielen verschiedenen Tönen leuchtet woran liegt das?
2 Antworten

...... spannende Frage, Danke!
Helium kann in verschiedenen Farben leuchten, wenn es elektrisch angeregt wird, wie es etwa in Gasentladungsröhren oder Neonröhren der Fall ist.
Das Phänomen hinter dieser farbigen Emission ist die Elektrolumineszenz, die auftritt, wenn Elektronen in den Heliumatomen durch elektrische Energie auf höhere Energiezustände angehoben werden und dann auf ihre ursprünglichen Zustände zurückfallen, während sie Photonen (Lichtteilchen) emittieren.

Die Farben, die dabei entstehen, hängen von den spezifischen Energieübergängen ab, die die Elektronen durchmachen. Bei Helium können diese Farben insbesondere umfassen:
Rosa bis Rot: Dies ist die häufigste Farbe, die man sieht, wenn Helium in Neonröhren verwendet wird. Sie resultiert aus den Übergängen der Elektronen, die zur Emission von Licht im sichtbaren roten Spektralbereich führen.
Blau bis Violett: Wenn Elektronen von noch höheren angeregten Zuständen auf niedrigere Zustände zurückfallen, kann Helium auch blaues bis violettes Licht emittieren. Diese Farben sind typisch für energiereichere Übergänge.
Weiß: In manchen Fällen, besonders wenn Helium unter hohen Drücken elektrisch angeregt wird, kann die Emission verschiedener Spektrallinien kombiniert werden, sodass das resultierende Licht weiß erscheint.
Die spezifische Farbe des emittierten Lichts kann auch durch andere Faktoren wie Druck, Stromstärke und die Beschaffenheit der Entladungsröhre beeinflusst werden. Jeder dieser Faktoren kann die Energiezustände der Elektronen und damit die Farbe des emittierten Lichts verändern.
Isotope von Helium können ebenfalls unterschiedlich leuchten, besonders in Bezug auf spektroskopische Eigenschaften wie Emissions- und Absorptionsspektren. Diese Unterschiede sind jedoch meist sehr subtil und erfordern präzise Instrumente, um sie zu detektieren. Die Gründe für die unterschiedliche Leuchteigenschaften von Isotopen liegen hauptsächlich in der sogenannten Isotopenverschiebung.
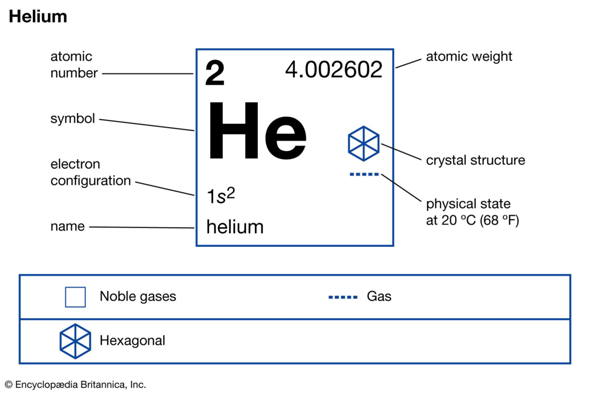
Helium ist ein Edelgas, dem zu Folge auch im Edelgaszustand. die gefüllte äußere Schale bewirkt das es kaum mit etwas anderen reagieren kann.
Andere Edelgase zeigen ebenfalls ähnliche Eigenschaften, wenn es um die Emission von Licht unter elektrischer Anregung und die Isotopenverschiebung geht. Jedes Edelgas kann leuchten, wenn es in einer Gasentladungsröhre elektrisch angeregt wird, und die spezifischen Farben, die emittiert werden, sind charakteristisch für die jeweiligen Energieübergänge der Elektronen in den Atomen des Gases.
Neon: Leuchtet typischerweise in einem hellen Rot-Orange, was Neonröhren ihre charakteristische Farbe verleiht.
Argon: Emittiert Licht in einem blassen Blau, was häufig in Leuchtstofflampen und anderen Beleuchtungen verwendet wird.
Krypton: Zeigt eine Reihe von Farben je nach den verwendeten Bedingungen, meist aber leuchtet es in einem grünen oder gelben Licht.
Xenon: Bekannt für seine helle weiße Emission, die in Xenon-Lichtbogenlampen verwendet wird, wie sie beispielsweise in Filmprojektoren oder Fahrzeugscheinwerfern zu finden sind.
Die Isotopenverschiebung tritt auch bei diesen Edelgasen auf.
mfe

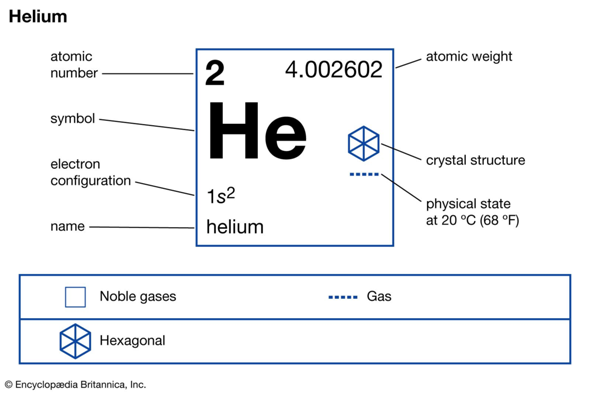

Das ist ja mal eine baba Antwort. Vielen Dank, hat mir sehr geholfen.

Man muss berücksichtigen unter welchen Umständen etwas eine andere Farbe bekommt. Chemische Reaktionen können Farben beeinflussen, aber wenn du es normal in die Luft pustest ist es eig farblos.