Warum haben Ether nur schwache Dipol-Dipol-WW?
Beispiel: H5C2-O-C2H5, Diethylether
3 Antworten

Wenn du das Molekül aufzeichnest, siehst du dass das Beispielmolekül Symmetrisch ist. Dann ziehen von beiden Seiten die Atome etwa Gleich und Das Molekül hat eine schwache Dipol-Dipol. Das ist wie beim Seilziehen. Wenn beide Seiten Gleich fest ziehen, bewegt sich das Seit trotz des grossen Kraftaufwands nicht. Da das O eine sehr hohe Elektronegativität hat, Zieht es am meisten. Je mittiger es aber ist, desto gleichmässiger zieht es aus allen Richtungen des Moleküls. Ether haben an dem O noch etwas hängen. Das bringt das O automatisch näher in die Mitte und der oben genannte Effekt passiert. Hoffe das ist klar, sonst einfach nachfragen


Den anderen beiden Antworten zum Trotz. Es liegt nicht an der Symmetrie des Moleküls. Man lernt zwar immer, dass symmetrische Moleküle keinen Dipol haben, allerdings muss man da aufpassen, was das für eine Symmetrie ist. Im symmetrischen CCl4 z.b. ziehen die Cl in alle vier Richtungen gleich stark. Das heißt, ihre Dipolmomente heben sich gegenseitig auf. In Molekülen wie Wasser oder CH2Cl2 ist das aber nicht so. Sie sind zwar symmetrisch, allerdings nicht so, dass sich die Dipolmomente aufheben. Siehe hier:
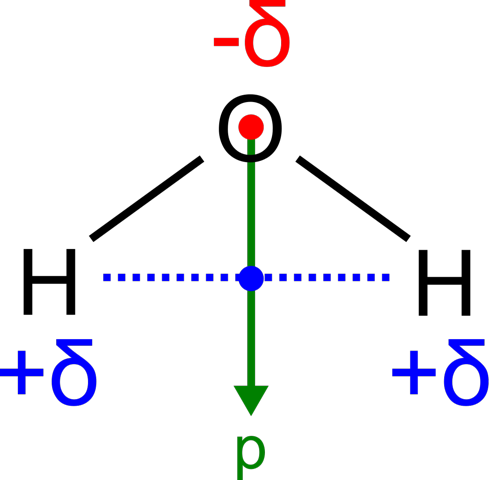
Aus dem selben Grund hat auch ein Ether einen permanenten Dipol. Der Grund, warum der nicht so sehr zum Tragen kommt, ist hauptsächlich sterischer Natur. Die Kohlenwasserstoffreste sind zu groß, als dass sich zwei Moleküle vernünftig mit ihren Dipolen aneinander lagern könnten. Daher kommen in Ethern quasi nur die vdW Kräfte zum Tragen. (Außer in cyclischen Ethern. Da führt die Ringstruktur zu einem stärkeren Dipol, der sterisch auch etwas weniger abgeschirmt ist)
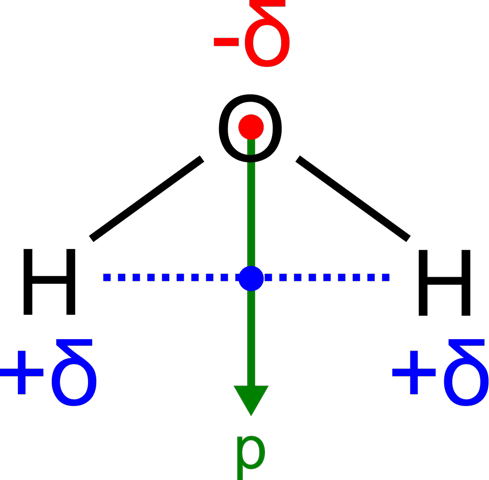

Weil Ether kein Dipol ist. Bei symmetrischen Molekülen fallen die Ladungsschwerpunkte zusammen. Ein anderes Beispiel dafür wäre O=C=O. Das ist komplett linear und obwohl die einzelnen Bindungen start polar sind, fallen die Schwerpunkte zusammen und das Molekül ist kein Dipol.
m.f.G.
anwesende

selbstverständlich fallen bei Punktsysmmetrie die Ladungsschwerpunkte zusammen. Das ist reine Mathematik.
nachfolgend die vollständige Erklärung; ich war aber der Meinung, daß dies für den Fragesteller zu kompliziert ist
Sowohl im Ethanol- als auch im Diethylether-Molekül findet man eine Bindung zwischen einem Sauerstoff- und einem Kohlenstoff-Atom. Aufgrund der Elektronegativitätsdifferenz zwischen Kohlenstoff- und Sauerstoff-Atomen ist die Bindung polar. Sowohl Ethanol- als auch DiethyletherMoleküle besitzen ein permanentes Dipolmoment, sodass zwischen den Ethanol- bzw. Diethylether-Mole-küle Dipol-Dipol-Kräfte wirken. Im Ethanol-Molekül findet sich aber im Gegensatz zum Diethyl-ether-Molekül eine Hydroxygruppe. Die Bindung zwischen dem Wasserstoff- und dem Sauerstoff-Atom der Hydroxygruppe ist stark polar, mit einer positiven Partialladung am Wasserstoff-Atom und einer negativen am Sauerstoff-Atom. Diese partial positiv geladenen WasserstoffAtome treten in Wechselwirkung mit den nicht bindenden Elektronenpaaren der Sauerstoff-Atome von anderen Ethanol-Molekülen. Es bilden sich Wasserstoffbrücken aus. Diese sind stärker als Dipol-Dipol-Kräfte, was die im Vergleich zu Diethylether erhöhte Siedetemperatur von Ethanol erklärt.

Das ist keine Erklärung für das Zusammenfallen der Ladungsschwerpunkte, sondern nur, warum Ethanol einen höheren Siedepunkt hat.
Das Dipolmoment am Diethylether kann man sogar beziffern: 1,14 Debye. Das ist jetzt nicht wenig H2S hat nur 0,97 und H2O 1,84
Ein Ether hat aber einen Dipol. Die Ladungsschwerpunkte fallen da nicht wirklich zusammen.