Stoffmenge Sauerstoff und Wasserstoffperoxid?
Hallo,
Bei einer Aufgabe habe ich Wasserstoffperoxid(H2O2) gegeben, welche sich in Sauerstoff und Wasser zersetzt. Die Masse von 8 mol Wasserstoffperoxid beträgt 272g. Welche Stoffmenge an Sauerstoff entsteht bei der Zersetzung von 8 mol Wasserstoffperoxid?
Danke schon einmal im Voraus:)
1 Antwort
Wasserstoffperoxid zerfällt zu Wasser und Sauerstoff. Dabei lautet die Reaktionsgleichung wie folgt:
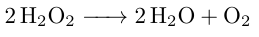
Aus der Reaktionsgleichung geht hervor, dass die entstehende Stoffmenge an Sauerstoff halb so groß ist, wie die des reagierenden Wasserstoffperoxids. Daraus ergeben sich die folgenden Zusammenhänge:
Setzt man nun die dazugehörigen Zahlen ein, so erhält man die Stoffmenge des freiwerdenden Sauerstoffs.
Folglich werden 4 Mol Sauerstoff frei. Mithilfe der Molaren Masse M kann man zusätzlich noch die Masse berechnen:
Das heißt, es werden 128g Sauerstoff frei.
~Johannes
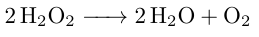
Ja. Die Stoffmenge des Wassers ist gemäß Reaktionsgleichung äquivalent zur Stofgmenge des Wasserstoffperoxids. Das heißt, die Stoffmenge des Wassers beträgt ebenfalls 8 mol. Ausgehend von der molaren Masse des Wasser von M = 18 g/mol ergibt sich eine Masse von 144 g.
~Johannes
Hey, ich hätte noch eine Frage. Könnte man jetzt auch die Stoffmenge und Masse des 2H2O berechnen?