Da steht k(drift) >> k(cis) > k(trans).
k(drift) steht für den stereochemischen Drift, weil dir auf diese Weise dein Hauptprodukt "entgleitet".
Steht auch nochmal im Brückner / 3. Aufl. auf Seite 460.
Da steht k(drift) >> k(cis) > k(trans).
k(drift) steht für den stereochemischen Drift, weil dir auf diese Weise dein Hauptprodukt "entgleitet".
Steht auch nochmal im Brückner / 3. Aufl. auf Seite 460.
Die Steuerung der Selektivität bei der Wittig-Reaktion ergibt sich primär durch die entstehenden Ylide, die sich aus den Edukten ergibt. Ist das P-Ylid labil, dann hast du eine hohe cis-Selektivität. Ist es stabil, dann hast du eine erhöhte trans-Selektivität.
Wenn du anderweitig die Selektivitäten modifizieren willst, dann kannst du beispielsweise auf die Schlosser-Variante mit trans-Selektivität zurückgreifen. Dabei verwendest du dann analog zur Wittig Phosphane.
Die Wittig-Horner-Reaktion verwendet Phosphanoxide, wobei im Gegensatz zur Wittig-Reaktion die Bildung des Oxaphosphetans mehrstufig verläuft. Die Selektivität kann dabei in Abhängigkeit von der Reaktionsführung von 1:1 (trans/cis) zu 1:9 (trans/cis) gesteuert werden.
Bei der Horner-Wadsworth-Emmons-Reaktion (HWE) handelt es sich bei größeren Aldehyden (z.B. R = COOR') um eine E-selektive Reaktion. Sie wird oft zur Darstellung alpha-beta-ungesättigter Ester verwendet. Bei der Phosphorverbindung handelt es sich um ein mehrfach verestertes Phosphonat
Die Still-Gennari-Variante der HWE führt zu cis-Selektivität, wobei Kalium-Ionen und 18-Krone-6 zum Einsatz kommen.
Wittig-, Wittig-Horner und HWE unterscheiden sich zusammengefasst durch die verwendete Phosphorverbindung und daraus resultierende mechanistische Unterschiede. Die Selektivitäten sind bei den meisten Reaktionsvarianten jedoch nicht wirklich in Stein gemeißelt und können durch die geschickte Substituentenwahl gesteuert werden.
Sulfat: SO4^(2-), Salz der Schwefelsäure
Sulfid: S^(2-)
Demnach sind Aluminiumsulfid und -sulfat verschiedene Verbindungen.
Aluminiumsulfat: Al2(SO4)3
Aluminiumsulfid: Al2S3
https://www.youtube.com/watch?v=bGBYGWBSzOs
Hi, Acetophenon scheint mir eine plausible Erklärung zu sein. Die Peaks zwischen 7 ppm und 8 ppm sind aromatische Peaks. Der Peak bei 8 ppm ist jedoch etwas nach links verschoben; also entschirmt. Dies ist vermutlich durch den -M-Effekt der am Ring anliegenden Carbonylgruppe. Selbiges scheint auf die Methylgruppe zuzutreffen.
~Johannes
Anfänglich würde ich den vorliegenden Kreisprozess einfach hinsichtlich der verschiedenen Zustandsänderungen klassifizieren und in einem pV-Diagramm darstellen. Der klassische Carnot'sche Kreisprozess verläuft wie folgt:
1) Isotherme, reversible Expansion
2) Adiabatische, reversible Expansion
3) Isotherme, reversible Kompression
4) Adiabatische, reversible Kompression
Bei deinem Kreisprozess werden jedoch die im Folgenden beschriebenen Zustandsänderungen durchlaufen. Ich habe dir mal die Formeln entsprechend dazugeschrieben.
1 -> 2: Isochore Zustandsänderung:
2 -> 3: Isobare Zustandsänderung:
3 -> 4: Isotherme Zustandsänderung
4 -> 1: Isobare Zustandsänderung
~Johannes
Buttersäure riecht nach Erbrochenem. Die Ester der Buttersäure riechen fruchtig.
https://de.wikipedia.org/wiki/Butters%C3%A4ureester
~Johannes
Wenn ein neutral geladenes Atom ein Elektron aufnimmt, so ist es negativ geladen. Negativ geladene Atome nennt man Anionen.
Gibt ein neutral geladenes Atom jedoch ein Elektron ab, so ist es positiv geladen. Positiv geladene Atome nennt man Kationen.
Das Ganze ist auf die vorliegende Kernladung zurückzuführen. Vereinfachend nehmen wir an, dass die Ladung eines Protons im Kern +1 beträgt und die Ladung eines Elektrons in der Elektronenhülle -1. Bei neutralen Atomen sind die Protonenzahl und Elektronenzahl identisch, folglich ergibt sich als Gesamtladung des Atoms 0.
Wird nun ein Elektron aus der Elektronenhülle entfernt, so haben wir ein Proton mehr als ein Elektron im Atom. Die Gesamtladung beträgt folglich +1, es liegt ein Kation vor.
Dasselbe gilt analog für das Hinzufügen eines Elektrons, wodurch die Gesamtladung -1 beträgt.
Ein klassisches Alltagsbeispiel ist dabei Kochsalz, das aus Natriumchlorid besteht. Gibst du dieses nun in das Wasser, so dissoziiert dieses und es liegen Natrium-Kationen und Chlorid-Anionen vor.
~Johannes
Ob ein Atomkern durch Entfernung eines Neutrons stabiler oder instabiler wird, kann so pauschal nicht gesagt werden. Es gilt dabei einige Regeln zur Beurteilung der Nuklidstabilität zu beachten.
Betrachtet man leichtere Elemente so gibt es zur Abschätzung für die Stabilität das Verhältnis von Neutronenzahl N und Protonenzahl Z. In der Regel hat man für N/Z ≈ 1 einen stabilen Atomkern. Das sieht man beispielsweise gut für N-14 (N = 7, Z = 7), wobei es sich um einen stabilen Atomkern handelt. Würden wir nun ein Neutron entfernen, so würden wir das instabilere N-13 (N = 6, Z = 7, t = 9.95 m) erhalten.
Betrachten wir nun ein N-16 (N = 9, Z = 7) Atomkern, so würden wir durch entfernen eines Neutrons einen N-15 (N = 8, Z = 7) Atomkern erhalten, welcher ebenfalls stabil ist. Folglich erhalten wir durch Entfernen eines Neutrons einen stabileren Kern.
Grob kann man also sagen, dass das Entfernen von Neutronen aus einem Nuklid aus einem protonenreichen Kern (links von der Linie der beta-Stabilität) zu instabileren Nukliden und das Entfernen von Neutronen aus einem Nuklid aus einem neutronenreichen Kern (rechts von der Linie der beta-Stabilität) zu stabileren Nukliden führt.
~Johannes
Ausgangslage ist ein gelöstes Goldsalz. Geht man beispielsweise von der Cyanidlaugerei bei der Goldgewinnung aus, so liegt das Gold als Na[Au(CN)2]-Komplex vor. Elementares Gold erhält man schließlich durch die Zugabe von Zinkpulver, wodurch das Gold reduziert wird und ausfällt.
Das Ganze kann dann weiter durch Filtration oder andere physikalische Trennmethoden aufgetrennt werden.
~Johannes
Die Benennung deinerseits sollte eigentlich stimmen. Lediglich wird SCN- als Thiocyanato (bzw. Isothiocyanato) benannt.
~Johannes
Ich habe dazu ein Paper aus dem Journal of Physical Chemistry gefunden: https://pubs.acs.org/doi/full/10.1021/jp901949b#
Darin beschreiben sie - wenn ich das richtig verstanden habe - ein neues Bindungsmodell; "recoupled pair bonding"
Um das aber genauer erklären zu können, müsste ich mich da wesentlich mehr reinlesen.
~Johannes
Im Sulfit-Ion sind zwei Elektronen der Doppelbindung des Sauerstoffs delokalisiert, weswegen sich drei verschiedene Grenzformel ergeben. Jede dieser Grenzstrukturen gibt dabei nur einen Grenzzustand wieder. Die Realität liegt irgendwo dazwischen. Sollte das Thema jedoch noch nicht behandelt worden sein, so ist es wahrscheinlich ausreichend, eine der Grenzstrukturen als Strukturformel anzugeben.

(https://wikipedia.org)
Eine Strukturformel, welche die Delokalisierung dementsprechend berücksichtigt und in einer Strukturformel darstellt, ist die folgende Strukturformel.

(https://wikipedia.org)
~Johannes
Aktivkohle hat keine H- und P-Sätze, da diese nach GHS kein gerfährlicher Stoff ist. Die dazugehörigen Informationen findest du in der Gestis-Stoffdatenbank: https://gestis.dguv.de/search
Hier noch einmal der Eintrag zu Aktivkohle: https://gestis.dguv.de/data?name=004340
In der Kategorie "Vorschriften" sind bei nach GHS als gefährlich klassifizierten Stoffen H- und P-Sätze vorzufinden.
~Johannes
Der zu zeigende Mechanismus ist die radikalische Bromierung von Methan. Am Anfang jedes Radikalreaktionsmechanismus ist die Initiation (Startreaktion). Dabei gilt es das entsprechende Radikal, also ein Atom mit einem ungepaarten Elektron, zu erzeugen. Im Falle von Brom geschieht das mittels Lichteinwirkung.

Nachdem das Radikal gebildet wurde, reagiert ebendieses mit dem Methan. Dieser Schritt wird Propagation (Kettenfortpflanzung) genannt.

Das erzeugte Methanradikal reagiert dabei beispielsweise mit einem Brommolekül.

Zu guter Letzt erfolgt die Termination (Kettenabbruch). Hierbei reagieren zwei Radikale miteinander.

Die Bildung höher bromierter Spezies ergibt sich durch weitere Radikalreaktionen von Brommethanen mit Brom.
~Johannes
Grund hierfür ist, dass das Ergebnis in der Einheit mol erhalten werden soll. Ohne den Faktor 10^3 hätte man letztendlich die Einheit kmol.
~Johannes
Ursache hierfür sind unterschiedlich starke Wasserstoffbrücken zwischen den einzelnen Molekülen. Aufgrund der hohen Elektronegativitätsdifferenz von Fluor und Wasserstoff (d = 1.8) sind HF-Moleküle stark polarisiert, wodurch zwischen unterschiedlichen HF-Molekülen auch dementsprechend starke Bindungen vorliegen.
Da die Elektronegativitätsdifferenz von Chlor und Wasserstoff (d = 1.0) geringer ist, ist das HCl-Moleküle dementsprechend weniger polarisiert und folglich liegen auch schwächere Wasserstoffbrücken vor.
~Johannes
~Johannes
Der gewählte Indikator für die Titration von Salzsäure mit Natronlauge ist beispielsweise Phenolphthalein. Dieser ist von einem pH-Bereich von 0 bis etwas 8.2 farblos, und ändert seine Farbe in einem pH-Bereich von 8.2 bis 12 zu rosa-violett.
Betrachten wir nun unsere Titration von 0.1 M Salzsäure mit 0.1 M Natronlauge. Anfänglich haben wir eine hohe Konzentration an Oxoniumionen, die mit der Zugabe von Natronlauge stetig abnimmt. Kurz vor dem Äquivalenzpunkt ändert sich nun der pH-Wert schlagartig, da die Oxoniumionen-Konzentration so gering ist, dass diese durch beispielsweise nur einen Tropfen 0.1 M Natronlauge wesentlich überkompensiert wird. Weswegen der pH-Wert schlagartig (Abbildung: Graph a) steigt.
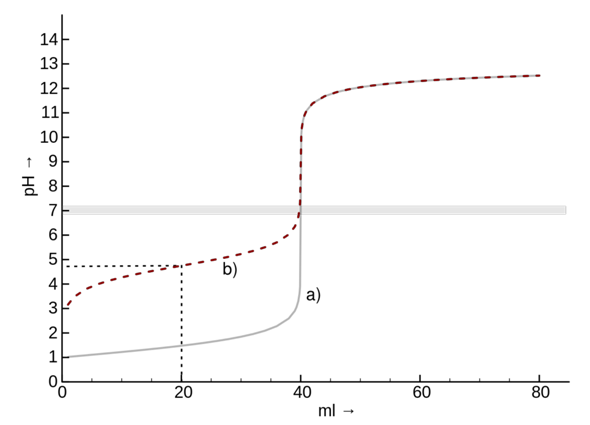
Dabei schlägt ab einem pH-Wert von 8.2 unser Indikator von farblos zu rosa-violett um.
Kurz vor dem Äquivalenzpunkt ist beim Eintropfen an der Eintropfstelle schon eine rosa-violette Verfärbung zu sehen. Dies ist darauf zurückzuführen, dass an der Eintropfstelle - je nach Rühren - kurzzeitig ein hoher pH-Wert, aufgrund der lokal hohen Hydroxidionen-Konzentration, vorliegt. Durch Rühren verteilen sich die Teilchen in der Lösung und der pH-Wert ist überall wieder nahezu identisch.
~Johannes
Anfänglich gilt es sich einen Überblick über die Stoffmengenverhältnisse zu schaffen, welche vorliegen. Hierzu wird die Reaktionsgleichung aufgestellt.
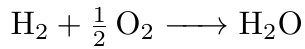
Daraus geht hervor, dass ein Mol Wasserstoff mit einem halben Mol Sauerstoff zu einem Mol Wasser reagiert. Das heißt, die Stoffmenge an Wasserstoff ist doppelt so groß, wie die Stoffmenge des eingesetzten Sauerstoffs. Dieses Verhältnis der Stoffmengen n gilt es nun in einer Gleichung darzustellen.
Für die Aufgabenstellung ist dabei nur das Stoffmengenverhältnis von Wasserstoff und Sauerstoff notwendig. Zudem gilt es den Zusammenhand zwischen Stoffmenge, Masse und Molarer Masse herzustellen, wobei die Stoffmenge der Quotient aus der Masse m und der Molaren Masse m eines Stoffes ist.
Diesen Zusammenhang gilt es nun in das obere Stoffmengenverhältnis einzusetzen.
Da nach der Masse des eingesetzten Wasserstoffs gefragt ist, muss die Gleichung entsprechend umgestellt werden.
Die Molaren Massen M der einzelnen Stoffe kann man mithilfe des Periodensystems ermitteln, wobei sich M(O) = 16.00 g/mol und M(H)=1.01 g/mol ergibt. Für die Masse des Sauerstoff geben wir dabei die vorgegebenen 10g an.
Folglich benötigen wir etwa 1.26 g Wasserstoff, damit 10g Sauerstoff vollständig zu Wasser reagieren.
~Johannes