Redox Reaktion?
Wieso ist diese Gleichung falsch Redox:Na + O2–> NaO2
3 Antworten
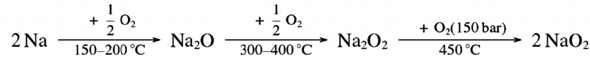
Die Gleichung ist nicht falsch. Diese Reaktion gibt es wirklich, aber sie ist schwer praktisch durchzuführen: Einerseits braucht man hohen Sauerstoffdruck (150 bar), andererseits darf die Temperatur nicht zu hoch sein (≈450 °C). Bei der Verbrennung von Na wird aber so viel Wärme frei, daß diese Temperatur überschritten wird und die Reaktion auf der Stufe des Na₂O₂ stehenbleibt, wenn man nicht großen experimentellen Aufwand treibt.
Die richtige Reaktionsgleichung für die unkontrollierte Verbrennung von Natrium an der Luft lautet also
2 Na + O₂ ⟶ Na₂O₂
und bei Sauerstoffmangel läßt sich die Verbrennung sogar bei Na₂O stoppen:
4 Na + O₂ ⟶ 2 Na₂O
Wenn man das weiße Na₂O bei ungehindertem Luftzutritt erhitzt, nimmt es entsprechend weiteren O₂ zu gelblichem Na₂O₂ auf, und dieses reagiert unter aggressiven Bedingungen (450 °C, 150 bar) weiter zum orangeroten NaO₂.

Sie ist so wie sie da steht falsch.
Natrium ist maximal einwertig, da es nur ein Elektron abgeben kann. In der Folge, kann die maximale positive Ladung nur 1 sein.
Sauerstoff ist in den meisten Fällen zweifach negativ geladen. Das bedeutet, man benötigt zwei positiv geladene Natrium-Ionen und ein zweifach negativ geladenes Sauerstoffatom, um die Gleichung auszugleichen und eine neutrale Ladung zu erhalten.
Folglich müsste die Reaktionsgleichung wie folgt lauten:
Die Gleichung ist nicht falsch, jedoch unvollständig. Bei sehr starker Erhitzung reagiert Natrium mit Sauerstoff zu Natriumoxid: 4Na + O2 -> 2Na2O. Um die Oxidation und Reduktion zu bestimmen sollte man sich die Oxidationszahlen des Reaktionpartners anschauen und im Produkt vergleichen. Natrium hat in NaO2 die Oxidationszahl +1, Sauerstoff -2. Sauerstoff hat also seine Oxidationszahl verändert, wodurch es sich oxidiert hat. Und Natrium, bislang in Elementarer Form +0 hat sich zu +1 reduziert. Ein weiteres Beispiel wäre Eisen und Silberionen: Fe + 2Ag+ -> Fe2+ + 2Ag, hier wird Eisen oxidiert und reagiert von +0 zu +2 und Silber von +1 zu +0 Also reduziere es sich und die Oxidationszahl geht von +1 zu +0. Um festzustellen ob ein Element reduziert oder oxidiert wird können immer two Regeln helfen. 1. die Oxidationszahlen aller übrigen Elemente (aktuellen) aufschreiben um zu sehen ob es sich erhöht oder verschiebt. 2. Es gibt ein Regel bei 2 unreinen Reaktionspartnern in Elementer Form. Gemeinsam werden die Elemente entweder oxidiert oder reduziert, zum Beispiel Cu2+ + Zn -> Cu + Zn2+( hier wird Zink oxidiert und Cu reduziert und beide beginnen Elementar) Bei Na o und (O2) O Beide bleiben gleich und das Elementar O O2 wird oxidiert und Na reduziert. Siehts du O2 bleibt O2 und Na oxidativ wird zu Na2O (4Na + O2 -> 2Na2O)