Protonen, Neutronen und Massenzahl
Heyy, ich wollte fragen, was hier die Protonen und Neutronenzahl ist. Außerdem würd ich gerne wissen, wie und wo man die Massenzahl herausfindet.. Danke im voraus, für eine Antwort. =)
LD Mika
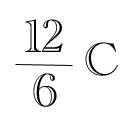
4 Antworten
Die untere Zahl ist die Protonenzahl oder Ordnungszahl. Sie gibt an, wie viele Protonen das Element besitzt. Im unegeladenen Zustand besitzt es ebensoviele Elektronen wie Protonen. Atomkerne besitzen meist neben den Protonen noch Neutronen, welche ebenso schwer wie die Protonen sind. Die obere Zahl ist die Massenzahl, sie ist die Summe aus Protonen und Neutronen. Da Neutronen und Protonen gleich schwer sind, gilt: Massenzahl = Protonenzahl + Neutronenzahl
oder:
Neutronenzahl = massenzahl - Protonenzahl
Einfach die Hälfte von 12 nehmen ist somit 6, dann hast du 6 Protonen, 6 Elektronen, 6 Neutronen also ist es Neutral geladen.
Bei Anionen und Kationen ist es entweder positiv oder negativ geladen, dass heißt, es sind nicht gleich viele vorhanden.
Das ist überall so, oder?? Auch bei den Beispielen? :
Neutronenzahl ist beim vorigen ist also so definiert:
Neutronenzahl = massenzahl - Protonenzahl = 12 - 6 = 6! Oder?

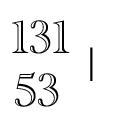
A=12=Massenzahl
Z=6=Kernladungszahl=Protonenanzahl=Elektronenanzahl (Atom ist ja elektrisch neutral)
N=A-Z=Massenzahl-Kernladungszahl=Neutronenanzahl.