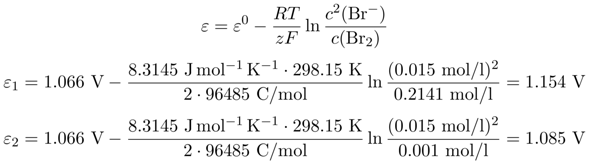Elektrochemie?
berechne das Potential einer Platinelektrode, die in eine mit Br2 gesättigte 0,015 M KBr-Lösung intaucht; E0=1,065 V
) berechne das Potential einer Platinelektrode, die in eine Lösung/Mischung aus 0,015 M KBr und
3r2 mit 0,001 M eintaucht; E0= 1,087 V
1 Antwort
Br₂ + 2 e¯ ⟶ 2 Br¯
Zunächst einmal brauchen wir ein Standardreduktionspotential, ich nehme das von Wikipedia ε⁰=+1.066 V weil Du keines angibst. Deine beiden Zahlenwerte ergeben keinen Sinn, weil sie ja gleich sein müssen, beide Male das Br₂/Br¯-Potential.
Außerdem muß man noch wissen, was die Konzentration von Brom in einer gesättigten wäßrigen Lösung ist; das ist leider nicht einfach, weil die Löslichkeit von der Bromidkonzentration abhängt, aber in Abwesenheit von genauerer Information muß ich den Wert in reinem Wasser, lt. Holleman 0.2141 mol/l bei 25 °C.
Für die erste Fragestellung haben wir also c(Br¯)=0.015 mol/l und c(Br₂)=0.21 mol/l, und für die zweite c(Br¯)=0.015 und c(Br₂)=0.001 mol/l. Das setzt man in die Nernst-Gleichung ein und fertig.

Die Antwort setzt allerdings voraus, daß ich Deine Frage überhaupt richtig verstanden habe; sie ist sehr schnoddrig formuliert und darüber hinaus noch so fürchterlich formatiert, daß selbst die Sau sich mit Grausen abwendet. Ist es wirklich zu viel verlangt, daß Du den Fragentext nach dem vergurkten c&p noch ein bißchen nacheditierst? Oder etwas mehr dazuschreibst als nur den Fragentitel „Elektrochemie“? Oder wenigstens alle nötigen Zahlenwerte lieferst?