Dissoziation Tyrosin und Glutaminsäure?
Hallo, die beiden Aminosäuren besitzen hat noch zusätzlich ein H in der Seitenketten. Dissoziieren sie?
2 Antworten
Der pKs-Wert der phenolischen OH-Funktion beim Tyrosin ist ca.10. Das heißt, dass diese in wässrigen Lösungen praktisch nicht dissoziiert ist. Phenole sind ausgesprochen schwache Säuren. Aber wenn man mit potenten Basen kräftig daran zupft, bildet sich ohne Problem das Phenolat.
Die Säurefunktion in der Seitenkitte der der Glutaminsäure hat einen pKs-Wert, der nahe bei dem der Essigsäure liegt (4,3). Dementsprechend ist die Gruppe auch etwas dissoziert.
Moin,
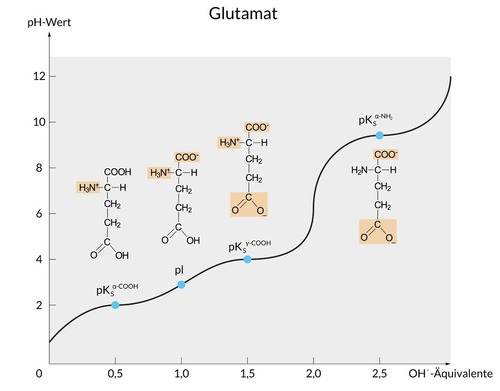
Glutaminsäure hat in der Seitenkette eine weitere Carboxygruppe (–COOH). Dementsprechend gibt es bei einer Titration mehrere Zustände des Protonierungsgrades und daher auch drei pKs-Werte (sowie einen isoelektrischen Punkt, pI):
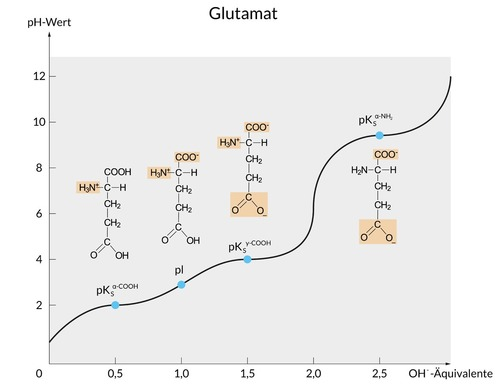
Im sehr sauren Bereich (etwa pH 2), ist Glutaminsäure vollständig protoniert, das heißt, dass beide Carboxygruppen (–COOH) und außerdem die Aminogruppe ein Proton tragen (–NH3+), so dass eine Ammoniumgruppe vorliegt.
Steigt nun der pH-Wert (durch Zugabe von Hydroxid-Anionen, –OH) auf etwa pH 3, so gibt zunächst die Carboxygruppe am alpha-C-Atom sein Proton ab und wird zur Carboxylat-Gruppe (–COO–).
An dieser Stelle liegt also ein Zwitterion vor, weil es sowohl eine positiv geladene Ammoniumgruppe als auch eine negativ geladene Carboxylatgruppe im selben Molekül gibt.
Das ist der isoelektrische Punkt (Zwitterionen richten sich in einem elektrischen Feld zwar aus, wandern aber nicht).
Steigt der pH-Wert noch weiter (auf circa pH 4), gibt auch die zweite Carboxygruppe ihr Proton ab.
Nun hast du ein negativ geladenes Ion vorliegen, in dem es eine protonierte (und dadurch positiv geladene) Ammoniumgruppe und zwei deprotonierte (und dadurch negativ geladene) Carboxylatgruppen gibt.
Erst bei noch höherem pH-Wert (um pH 10) wird auch die Ammoniumgruppe dann deprotoniert, so dass du ein zweifach negativ geladenes Anion vorliegen hast.
Deshalb gibt es bei Glutaminsäure drei pKs-Werte und einen isoelektrischen Punkt (pI).
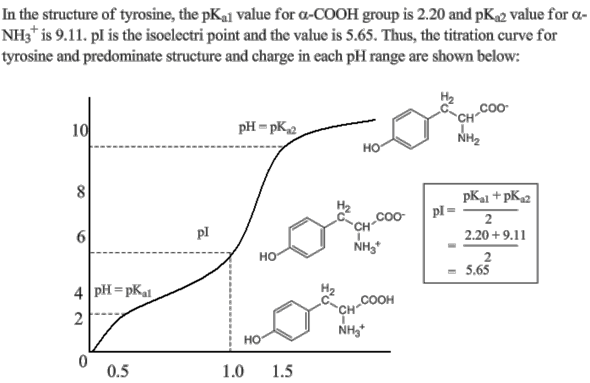
Bei Tyrosin ist das etwas anders.
Tyrosin hat eine Hydroxygruppe (an einem Benzen-Ring) in der Seitenkette. Hydroxygruppen sind ziemlich uninteressiert daran, ein Proton abzugeben, das heißt, sie sind sehr wenig sauer.
Deshalb ergibt sich bei der Titration etwa folgendes Bild:
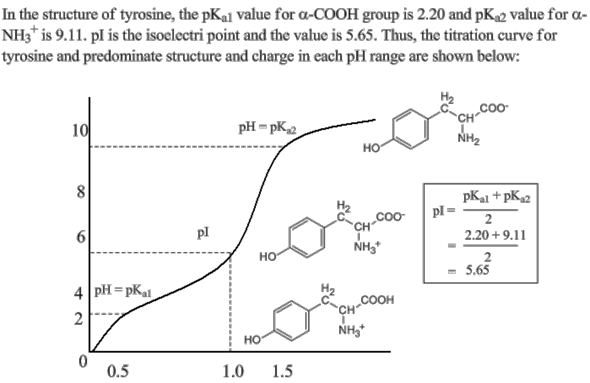
Hier hast du zwei pKs-Werte und auch einen isoelektrischen Punkt.
LG von der Waterkant