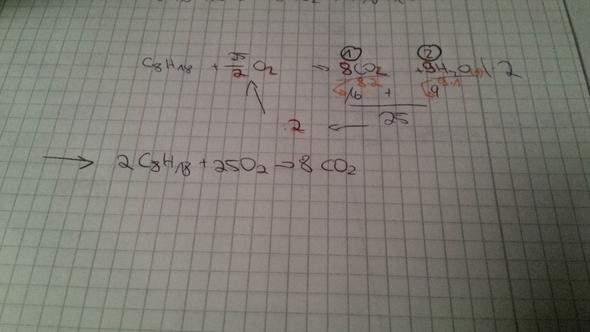Chemie vollständige verbennung octann?
DRINGENDE HILFE BITTE. Es geht um die vollständige Verbrennung von n-octan. Die molare Masse etc habe ich schon alles raus. Nur verstehe ich nicht wie man auf nochmal die reaktionsgleichung: 2 C8H18 + 25 O2 ---> 16CO2 + 18H2O kommt? Ich wäre echt dankbar wenn es jemand erklären könnte... :(
Danke im vorraus!!
2 Antworten
2C8H18 + 25O2 --> 16CO2 + 18H2O
Naja am anfang hast du nur
C8H18 + O2 --> CO2 + H2O
Das musst du ausgleichen
Sprich dass auf beiden seiten (also vor und nach der verbrennung) gleichviel von jedem stoff ist.
Man fängt beim C an und gleicht es aus. Du hast auf der einen Seite 8 und auf der anderen nur eins also schreibst du:
C8H18 + O2 --> 8CO2 + H2O
Dann schaust du nach den Hs.
Auf der einen Seite hast du 18 und auf der anderen 2.
also ausgeglichen:
C8H18 + O2 --> 8CO2 + 9H2O
Dann schaust du nach den Os.
Auf der einen seite 2 auf der anderen 25 also:
C8H18 + 12,5O2 --> 8CO2 + 9H2O
Rechne jz beides mal 2 damit keine komma zahlen mehr da sind
2C8H18 + 25O2 --> 16CO2 + 18H2O
Und fertig
Merke: Beginne beim Ausgleichen mit Kohlenstoff, dann Wasserstoff, und zum Schluss Sauerstoff.
Deine Ausgangsgleichung ist C8H18 + O2 reagiert zu CO2 + H2O