chemie Ionen.? 11?
Könnte mir jemand erklären (anhand einer beispielaufgabe), wie man auf die Lösungen kommt?
Danke im Voraus
2 Antworten
Was genau möchtest du denn wissen?
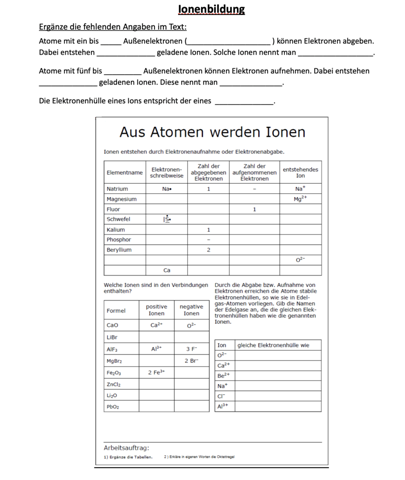
Ziel von Ionen ist es 8 Valenzelektronen zu besitzen (auf Edelgaskonfiguration kommen). Bei der oberen Tabelle steht z.B. Fluor. Wir wissen aus dem PSE, dass Fluor 7 Valenzelektronen besitzt. Wie kommt es jetzt am besten zu 8 Valenzelektronen? 1 Elektron nehmen oder seine 7 abgeben? Natürlich ist es energetisch günstiger, wenn es 1 Elektron aufnimmt. Deswegen kommt eine 1 in die Spalte "aufgenommene Elektronen". Da das Fluoratom 1 Elektron aufgenommen hat, ist es einmal negativ geladen, deswegen kommt in die Spalte negativ geladenes Ion "F-" hin. Das Minus signalisiert sozusagen, dass es einfach negativ geladen ist (und damit ein Anion ist).
Positiv geladene Ionen haben Elektronen abgebenen (positiv geladen, da nun mehr Protonen, als Elektronen vorliegen). Negativ geladene Ionen haben Elektronen aufgenommen (da nun mehr Elektronen, als Protonen vorliegen).
CaO ist eine Ionenverbindung. Hier liegen die Atome Ca (Calcium) und O (Sauerstoff) vor. Nun guckst du in dein PSE. Dort siehst du, dass Ca in der 2. Hauptgruppe ist und Sauerstoff in der 6.
Jetzt gehst du nach der oben beschriebenen achter Regel (diese ist ganz wichtig!) und schaust, wie es am günstigsten ist. Ist es besser, wenn Ca 2 Elektronen abgibt oder weitere 6 Elektronen aufnimmt, um an 8 Valenzelektronen zu kommen? Natürich ist es energetisch günstiger 2 Elektronen abzugeben. Diese gibt er an das Sauerstoffatom ab. Das Sauerstoffatom besitzt 6 Valenzelektronen und kommt nun auf 8 Valenzelektronen, wenn es die 2 Elektronen vom Calciumatom aufnimmt. Damit kommen beide auf eine stabile Edelgaskonfiguartion ( 8 Außen/-Valenzelektronen)
Das bezieht sich im Wesentlichen auf die ersten drei Perioden. Danach wird es unübersichtlich.
Schau dir folgendes Bild an:
https://de.wikipedia.org/wiki/Periodensystem#/media/Datei:Periodensystem_newdraft.svg
Lass dich für den Anfang nicht dadurch verwirren, dass Bor und einige andere Elemente als "Halbmetalel" bezeichnet werden. Richte dich am besten nach der 3. Periode (die mit Natrium beginnt) - da sind die Verhältnisse am "typischsten". Ebenso lass die hellblau markierten "Übergangsmetalle" weg.
Ein Atom oder Ion, das ein Elektron abgibt, rutscht eine Stelle nach links (Lücken werden übersprungen) bzw. von ganz links in die Zeile darüber ganz rechts.
Ein Atom oder Ion, das ein Elektron aufnimmt, rutscht eine Stelle nach rechts. (Edelgase nehmen keine Elektronen auf.)
Es werden grundsätzlich so viele Elektronen abgegeben bzw. aufgenommen, dass die "Elektronenkonfiguration" des nächstgelegenen Edelgases angenommen wird. Die Elemente der IV. Hauptgruppe (14. Gruppe) liegen genau zwischen zwei Edelgasen und bilden nur sehr ungern Ionen.
Elektronen haben eine negative Ladung - bei der Abgabe von Elektronen entstehen entsprechend positive Ionen, bei der Aufnahme von Elektronen entstehen negative Ionen.
Das sollte für die Beantwortung ausreichen.
und worin liegt der Unterschied zwischen negativ/positiv? und wie unterscheidet man bei CAO in C+ und O-?