Calcium?
Warum hat ein Calciumatom 4 Schalen, obwohl auf der 3. Schale 18 Elektronen passen?
Ist es bei den Hauptgruppen so, dass nur 8 Elektronen auf der 3. Schale passen?
Danke im Voraus!
2 Antworten
Moin,
das hat etwas mit dem Feinbau der Elektronenhülle zu tun.
Im 3. Hauptenergieniveau (in der 3. Schale) gibt es verschiedene Unterräume (sogenannte Orbitale), die verschiedene Energiestufen repräsentieren. Insgesamt gibt es im atomaren Grundzustand (= energieärmster Zustand) im 3. Hauptenergieniveau ein 3s-Orbital, drei 3p-Orbitale und fünf 3d-Orbitale. Jedes dieser Orbitale kann maximal zwei Elektronen aufnehmen. Das sind also maximal (2 + 6 + 10 =) 18 Elektronen. ABER: Das heißt nicht, dass alle diese Orbitale auch energetisch die günstigsten sind. Tatsächlich ist das 4s-Orbital aus dem 4. Hauptenergieniveau energetisch etwas günstiger als die fünf 3d-Orbitale aus dem Hauptenergieniveau davor. Dementsprechend werden nach dem 3s- und den drei 3d-Orbitalen zunächst das 4s-Orbital mit Elektronen befüllt, bevor die 3d-Orbitale Elektronen abbekommen. So kommt es, dass die Besetzung in der 3. Periode folgendermaßen aussieht:
Na (11 Elektronen): 1s^2 2s^2 2p^6 3s^1
Mg (12 Elektronen): 1s^2 2s^2 2p^6 3s^2
Al (13 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^1
Si (14 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^2
...
Ar (18 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6
Nun wird zunächst das energiegünstigere 4s-Orbital befüllt, bevor es (ab Scandium) an die 3d-Oritale geht:
K (19 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1
Ca (20 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2
Sc (21 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^1
Ti (22 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^2
...
Zn (30 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10
Fazit:
Mit zunehmender Atomgröße gibt es in der Schalenhierarchie der Hülle auch zunehmend mehr Aufenthaltswahrscheinlichkeitsorte (Orbitale). Daraus lässt sich aber nicht immer folgern, dass die Orbitale, die in einer Schale zur Verfügung stehen auch zwingend immer die energiegünstigsten sind. Wie die einzelnen Orbitale in den Schalen eines Atoms im Grundzustand zu besetzen sind, siehst du hier:
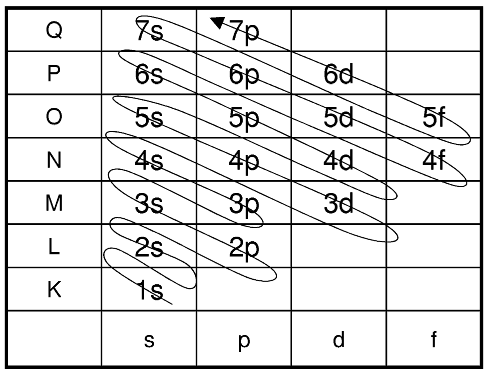
Aber selbst dieses Schema stimmt nicht immer zwingend. Es gibt gewisse Ausnahmen, zum Beispiel bei Chrom, Kupfer und ein paar mehr Elementen.
Das hat wiederum damit zu tun, dass offenbar zwei halbvoll besetzte oder ein halbvoll und ein voll besetztes Orbital energetisch günstiger sind, als wenn ein Orbital "irgendwie" besetzt ist.
Cr (24 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5
denn hier sind 4s und 3d jeweils halbvoll besetzt, was offenbar günstiger ist, als 4s^2 3d^4 (was energetisch die geforderte Besetzung wäre).
Cu (29 Elektronen): 1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^10
denn hier ist 4s halbvoll besetzt, während 3d voll besetzt ist, was offenbar günstiger ist, als 4s^2 3d^9 (wie es von den Energiestufen her "richtig" wäre).
Wenn dir das alles jetzt zu hoch war, gräm dich nicht. Das gehört zum Orbitalmodell des Atombaus und ist eine relativ schwierige Angelegenheit...
LG von der Waterkant
Die Energieniveaus von Unterschalen sind sehr unterschiedlich, je nachdem, ob die darunterliegenden Energieniveaus leer sind (Wasserstoff / wasserstoffähnliche Systeme) oder gefüllt (normale Atome). Der Unterschied ist umso größer, je höher die Nummer der Unterschale ist (für Fortgeschrittene: die "Bahndrehimpuls-Quantenzahl").
vgl. z. B. https://www.gutefrage.net/frage/warum-stehen-in-der-4-periode-nur-18-elemente-und-nicht-32