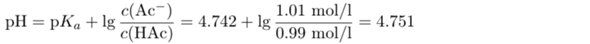Was rechnet man da?
Es wird eine Pufferlösung mit 1,00 mol/L Essigsäure (CH3COOH) und 1,00 mol/L Natriumacetat (CH3COONa) hergestellt. Sie hat einen pH-Wert von pH = pKS = 4,742.
Welchen pH-Wert hat Sie nach einer Zugabe von 0,01 mol/L NaOH?
Wir rechnen 4,742+Log(1-0,01/1+0,01) ist das falsch
1 Antwort
Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Chemie
Du willst also die Henderson-Hasselbalch-Gleichung verwenden. Diese Gleichung lautet richtig
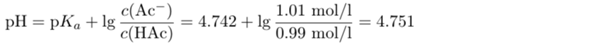
Wir bekommen also einen pH, der nur hauchknapp über dem pH der Ausgangslösung liegt. Wenn Du dieselbe Menge NaOH zu reinem Wasser gegeben hättest, dann wäre der pH natürlich von 7 auf 12 gestiegen, also um satte 5 Einheiten.
Woher ich das weiß:Studium / Ausbildung – Chemiestudium mit Diss über Quantenchemie und Thermodynamik