Verdünnen von Wasserstoffperoxid und Salzsäure?
Hi allerseits.
Gibt es eine Berechnungsformel wie ich 33prozentige Salzsäure mischen muss das sie nur noch 24prozent hat?
Ebenso beim wasserstoffperoxid. Da hab ich 3%IG und benötige 1%Igel Lösung.
Für Hilfe wäre ich dankbar
2 Antworten

Beim Wasserstoffperoxid ist es einfach: Du verdünnst aufs dreifache Volumen (also z.B. 100 ml H₂O₂ 3% plus 200 ml Wasser = 300 ml H₂O₂ 1%). Das kannst Du machen, weil alle drei Flüssigkeiten ungefähr dieselbe Dichte von 1 g/ml haben.
Bei der HCl würdest Du nach gleicher Rechnung zum Schluß kommen, Du müßtest 8+3 verdünnen; das stimmt auch, aber die Verhältnisse gelten für Massen (also z.B. 73 g HCl plus 27 g H₂O). Wahrscheinlich willst Du lieber mit Volumina arbeiten, und die kannst Du nicht blind aus den Massen übertragen, weil die Flüssigkeiten eine unterschiedliche Dichte haben. Die 33%ige HCl hat ρ₃₃=1.164 g/ml, die 24%ige ρ₂₄=1.118 g/ml und das Wasser natürlich ρ₀=1 g/ml.
Mit ein bißchen Rechnerei findet man heraus, daß Du z.B. 69.8 ml der HCl (w=33%) mit 30.5 ml Wasser mischen mußt, um genau 100 ml HCl (w=24%) zu erhalten. Du siehst, daß sich die Zahlen nicht sehr unterscheiden, und letztlich mußt Du wissen, wie genau Deine Konzentrationen sein müssen.

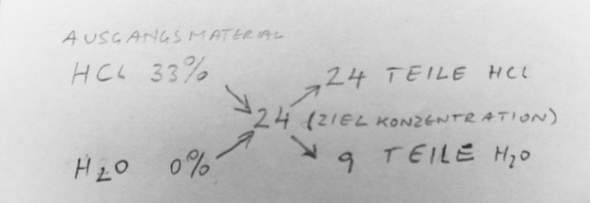
Die einfachste Methode ist das Mischkreuz!
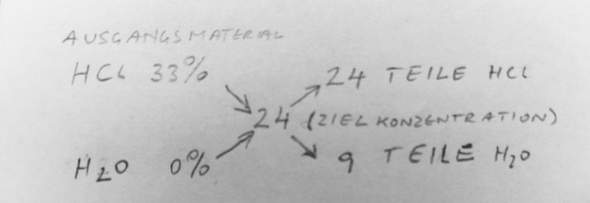
Und sinngemäß auch mit anderen Mischpartnern.