Titrationskurve interpretieren?
Ich schreibw morgen eine Chemie Klausur, aber unser Lehrer ist nicht wirklich gut... Auf der Liste was wir können soll stand dass wir titrationskurven interpretieren können sollen aber ich hab das davor noch nie gehört. Ich hab ein bisschen im Internet geguckt und habe dann erkannt, dass wir Mal eine Kurve gezeichnet haben und dass das diese Titrationskurve ist.
Aber ich weiß immer noch nicht was diese Kurve mir sagt oder was ich darin ablesen können soll... Kann mir einer helfen?
1 Antwort
Ich habe Dir zwei Titrationskurven aufgezeichnet.
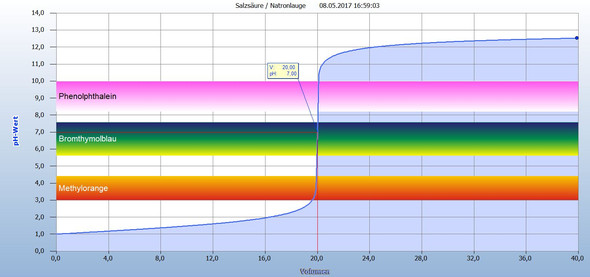
a)
In der ersten Kurve wurde V(Salzsäure) = 20 mL der Konzentration c = 0,1 mol/L vorgelegt und mit Natronlauge der gleichen Konzentration titriert.
Du siehst, dass nach Zugabe der Natronlauge sich der pH kaum ändert und dann schlagartig ansteigt. In der Mitte des Steilanstiegs ist der Äquivalenzpunkt. Hier ist die vorgelegte Salzsäure durch die Natronlauge neutralisiert worden. Der pH = 7, und man benötigte V(Natronlauge) = 20 mL, also das gleiche Volumen. pH = 7 heißt auch Neutralpunkt.
Hätte die Natronlauge eine größere Konzentration gehabt, dann hätte man weniger von ihr benötigt. Umgekehrt wäre es gewesen, wenn mann eine Natronlauge mit geringerer Konzentration als die der Salzsäure verwendet hätte.
Ich habe Dir drei Indikatoren eingezeichnet, die alle für diese Titration geeignet wären. Warum, das erfährst Du bei der 2. Kurve.
Eigentlich könnte man diese Titration hier abbrechen.
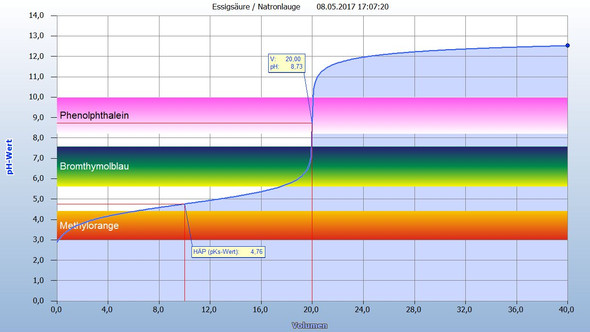
b)
In der zweiten Kurve wurde V(Essigsäure) = 20 mL der Konzentration c = 0,1
molL vorgelegt und mit Natronlauge der gleichen Konzentration titriert.
Du siehst, dass die Titration bei höherem pH beginnt, denn die Essigsäure (HAc) ist schwächer als HCl. Der Äquivalenzpunkt (Wendepunkt der Kurve) ist auch nach V = 20 mL Zugabe an Natronlauge erreicht. Aber, wenn Du genau hinsiehst, der pH = 8,73. Erst bei diesem pH wurde die ganze Säure umgesetzt.
Der pH = 7, also der Neutralpunkt und der Äquivalenzpunkt fallen nicht zusammen. Warum das so ist, musst Du sicher noch nicht erklären können.
Nun zu den Indikatoren: Man darf für eine Titration nur Indikatoren verwenden, die im Steilstück der Titrationskurve umschlagen. Du siehst, dass für diese Titration nur Phenolphthalein geeignet ist.
Es gibt noch einen Halbäquivalenzpunkt (hier bei pH = 4,76), der auch sehr wichtig ist, aber für Dich noch nicht.
Zum Abschluss: Warum macht man eine Titration? - Man will die Konzentration einer vorgelegten Flüssigkeit mit einer anderen Flüssigkeit bekannter Konzentration bestimmen. In der Nahrungsmittelindustrie spielt so etwas zum Beispiel eine Rolle.
Vielen Dank,
eine Super Erklärung. Du hast Dir sehr viel Mühe mit der Graphik gemacht, sogar die Umschlagsfarben hast Du reingekriegt.
Ich fürchte nur, in einem Land aus unfähigen Lehrern und hochintelligenten Schülern, die unter diesen Lehrern leiden müssen und deshalb ihre wahren Fähigkeiten nicht entwickeln können, wird Deine Antwort dem Fragesteller auch nicht viel nützen.