Teilchenebene der Bildung saurer Lösungen - Salzsäure Beispiel?
Wie bildet sich eine saure Lösung auf Teilchenebene, insbesondere bei Salzsäure? Kann jemand den Prozess verständlich erklären? Danke!
1 Antwort

Moin,
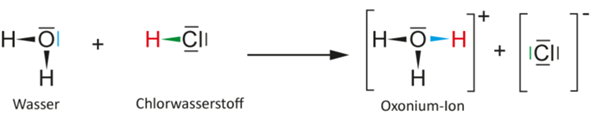
schau: das Hydrogenchlorid (HCl) ist unter normalen Bedingungen ein Gas. Es besteht auf Teilchenebene aus Molekülen, wobei ein Wasserstoff-Atom an ein Chlor-Atom über eine einzelne Elektronenpaarbindung verbunden ist.
Wasser (H2O) ist unter normalen Bedingungen eine Flüssigkeit. Auch die kleinsten Teilchen von Wasser sind Moleküle, wobei hier zwei Wasserstoff-Atome jeweils über eine Elektronenpaarbindung mit einem Sauerstoff-Atom verbunden sind.
Wenn du jetzt das gasförmige Hydrogenchlorid in das flüssige Wasser leitest, dann spaltet sich vom Hydrogenchlorid sofort der zuvor gebundene Wasserstoff (–H) in Form eines Protons (H+) ab, weil er das bindende Elektronenpaar beim Chlor-Atom lässt. Dadurch hat das ursprünglich ungeladene Chlor-Atom nun ein Elektron mehr bei sich (weil ja das Elektron, das in der Elektronenpaarbindung zuvor dem Wasserstoff-Atom gehörte, nun beim Chlor-Atom verblieben ist). Darum wird aus dem Chlor-Atom dann ein einfach negativ geladenes Chlorid-Anion. Als solches wird es von Wassermolekülen umringt, die eine Hydrathülle um das Ion ausbilden.
Das Proton (H+) ist allein nicht existenzfähig. Es wird von einem der freien Elektronenpaare eines Sauerstoff-Atoms im Wassermolekül eingefangen und gebunden. Dadurch entsteht ein einfach positiv geladenes Oxonium-Kation (H3O+). Auch dieses Oxonium-Ion wird von einer Wasserhülle umgeben.
Den ganzen Prozess kannst du auch in der chemischen Formelsprache als Reaktionsschema ausdrücken. Das sieht dann folgendermaßen aus:
HCl(g) + H2O(l) → H3O+(aq) + Cl–(aq)
(Gasförmiges Hydrogenchlorid und flüssiges Wasser reagieren zu in Wasser gelösten Oxonium-Ionen und Chlorid-Ionen.)
Du kannst das aber auch in Lewis-Schreibweise angeben. Dann erhältst du folgendes Bild:

Alles klar?
LG von der Waterkant