elektrophile Substitution?
Hi,
im Chemieunterricht hatten wir das Beispiel einer elektrophilen Substitution mit Vanillin und Catechin
Das ganze passiert säurekatalysiert, also zuerst über die Protonierung der Aldehydgruppe bei Vanillin und der damit verbundenen Bildung des Elektrophils.
Dann kommt es zum Angriff des Elektrophils am Catechin.
https://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcQ4wHpOsb-OSB92GAjvT8PHB9L8SJEnBm3anA&s
Was mich wundert, ist, warum das aromatische System weiterhin erhalten bleibt, obwohl ja eigentlich ein C-Atom sp3-hybridisiert sein müsste.
Nach der Abbildung bleibt das aromatische System erhalten, aber wie geht dann der elektrophile Angriff mit der Bildung des pi/sigma-Komplexes?
2 Antworten
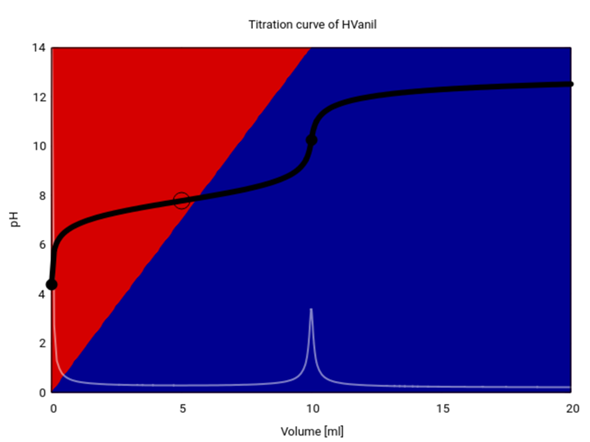
Beginnen wir mit der Titrationskurve. Hier habe ich eine schönere:

Du siehst, wie die rote Säureform (also das Phenol) im Lauf der Titration verschwindet und durch das blaue Phenolat ersetzt wird. Den pKₐ-Wert kannst Du bei 5 ml Verbrauch als pH ablesen; ich habe zur Berechnung den Wert pKₐ=7.781 von Wikipedia genommen. Vanillin ist als Säure also ungefähr 100-mal stärker als Phenol, darin ist der −M-Substituent schuld, der die negative Ladung auch über das Aldehyd-O delokalisieren kann.
Zur Berechnung der Kurve habe ich die Angaben aus Deinem Text (0.1 mol/l für beide Lösungen) verwendet, obwohl sich Vanillin nur zu ≈0.06 mol/l in Wasser löst.
In Deiner volumetrischen Gahaltsbestimmung hast Du 7 ml einer 0.01 mol/l NaOH verbraucht, das sind n=cV=0.07 mmol. Also betrug die Stoffmenge Vanillin im Kolben ebenfalls 0.07 mmol, in der ganzen Vanilleschote waren es fünfmal soviel also 0.35 mmol und das sind m=Mn=53 mg bzw. w=m/mᵥₐₙᵢₗₗₑ=2.4%, und das ist ein realistischer Wert.
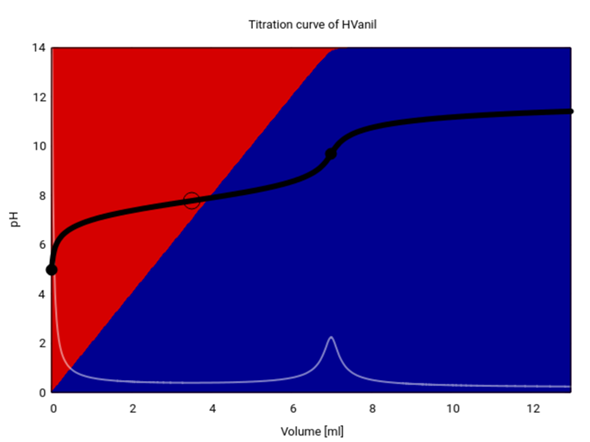
Spaßeshalber habe ich auch diese Titrationskurve ausgerechnet:

und frage mich, was wohl gemeint ist, wenn die Angabe „mit einem geeigneten Indikator“ schreibt — ich kenne keinen, der sich für einen so räudigen pH-Sprung eignet.
Jetzt kommen wir zur Nachweisreaktion. Dabei greift das C₈ des Catechins nukleophil an der Aldehydruppe an (wie bei einer Aldolkondensation), oder alternativ das Carbonyl-C des Vanillins elektrophil am aromatischen Ring (unter Ausnützung der aktivierenden und o,p-dirigierenden Wirkung der beiden Phenolgruppen). Beide Betrachtungsweisen sind natürlich gleichwertig.
Was mich wundert, ist, warum das aromatische System weiterhin erhalten bleibt
Redest Du hier vom Produkt? Du siehst doch, daß sich zuerst ein Alkohol (sp³) bildet, der dann Wasser abspaltet, damit sich das riesige π-System bilden kann. Die angegebene Grenzstruktur hat den ehemaligen Vanillin-Ring nicht aromatisch sondern chinoid, aber wenn Du auch Grenzstrukturen mit Formalladung zuläßt, dann gibt es auch welche, an denen das Vanillin aromatisch ist (also Phenolat), und dafür taucht dann eine positive Formalladung an einem O-Atom im Flavon-Gerüst auf.
Die Abbildung ist schlecht von der Qualität her, hier findet man sie im pdf deutlich besser aufgelöst