Atomhülle und Elektronenkonfiguration?
Ich habe folgende Frage zum Periodensystem: Bisher bin ich davon ausgegangen, dass die Anzahl der Elemente, die in einer Periode Platz haben, auch gleichzeitig darüber Auskunft gibt, wie viele Elektronen in die jeweilige Schale passen. Folglich wäre die Konfiguration für Phosphor K2L8M5, was ja auch stimmt. Beginnt man jedoch, diese Theorie in der vierten Periode zu überprüfen, wirds merkwürdig. Die Konfiguration für zB Germanium ist K2L8M18N4. Gemäss meiner Logik müsste sie jedoch K2L8M8N14 sein. Warum passen auf die dritte Schale (M-Schale) auf einmal 18 Elektronen, obwohl die dritte Periode nur acht Elemente beinhaltet. Ausserdem habe ich mal gelernt, dass sich die Schalen zuerst komplett füllen und dann eine neue angefangen wird. Dem widerspricht jedoch beispielsweise das Element Nickel, welches K2L8M16N2 hat. Warum wird da nicht erst die M-Schale auf 18 aufgefüllt?
Ich bin gerade einigermassen verwirrt, ich hoffe, jemand kann mich aufklären.
3 Antworten

Ich probiere deine Frage mal kurz mit einem Bild zu beantworten:
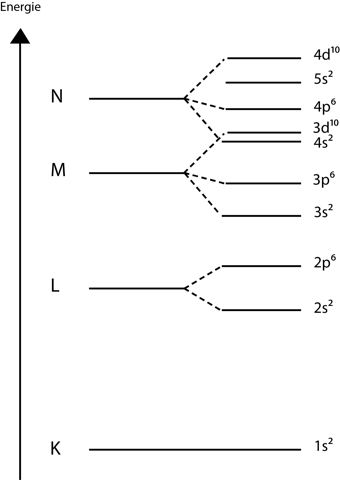
Hier siehst du, wie die Orbitale bzw. Schalen besetzt werden. Auffällig ist, dass das 4s^2 Orbital energetisch niedriger liegt als das 3d^10 Orbital, das heißt, dass das 4s^2 Orbital zuerst mit Elektronen besetzt wird. Die 10 Elektronen von der M Schale kommen aus dem 3d^10 Orbital. Dann gibt es noch Ausnahmen, wo Elektronen "wandern " können in andere Orbitale. Zwei halb besetzte Orbitale sind energetisch günstiger als ein vollbesetztes.....Ausnahmen sind zum Beispiel Nickel aber auch Kupfer und viele mehr.

Gute Fragen auf jeden Fall.
Das Schalenmodell kann dir leider keine befriedigende Antwort darauf geben.
Dennoch versuche ich es dir mal zu erklären: Die Anzahl der Elektronen die in eine Schale passen hängt nicht direkt von der Periode ab. So wird die Anzahl der Elektronen auf einer Schale durch die Formel 2×a^2 beschrieben, wobei a die Schalennummer ist. Daher passen auf die M Schale a=3 .... 18 Elektronen.
Für Nickel ist die ganze Sache etwas komplizierter.
Das Schalenmodell ist dafür nicht ausreichend. Schauen wir uns das Orbitalmodell an. Es gibt s, p, und d orbitale die hier relevant sind. Zuerst wird für Wasserstoff das 1s Orbital mit einem Elektron besetzt. In jedes Orbital passen 2 Elektronen. D.h. Helium hat 2 Elektronen im 1s Orbital. Man sagt Helium hat die Konfiguration 1s2. Nun wird in der 2. Periode als nächstes das 2s Orbital besetzt und wenn das voll ist, kommen die p Orbitale. Gab es vom s Orbital, das aussieht wie eine Kugel immer nur 1, gibt es von den p Orbitalen 3. Es sieht nämlich aus wie eine Hantel und die kann in x, y oder z Richtung ausgerichtet sein. In jedes der drei 2p Orbitale kommen 2 Elektronen. Neon hat also die konfiguration 1s2 2s2 2p6, oder wie man auch schreibt [He] 2s2 2p6, da 1s2 ja die Heliumkonfiguration ist. In der 3. Periode geht es wieder los mit 3s danach 3p. In der vierten Periode kommt nun der D Block ins Spiel. Hier fangen wir an mit 4s. D.h. Kalium hat die Konfiguration [Ar] 4s2. Doch bevor nun die energetisch hochliegenden 4p Orbitale besetzt werden, werden die 3d Orbitale besetzt da das weniger Energie erfordert. Von den d Orbitalen gibt es jetzt aber 5 verschiedene, also haben insgesamt 10 Elektronen dort Platz. Also sollte Nickel die Konfigutation [Ar] 4s2 3d8 haben. Die hat es auch. Allerdings wird darüber gestritten ob die Konfiguration [Ar] 4s1 3d9 nicht auch möglich ist, da es besonders günstig ist, halbvoll bzw. vollbesetzte Orbitale zu haben. Deswegen hat Kupfer auch die Konfiguration [Ar] 4s1 3d10 da hier das 4s Orbital halb und die 3d Orbitale voll sind. In der Tat ist die Konfiguration von Nickel aber ein großes Ding in der Quantenchemie und letzten Endes bieten auch beim Orbitalmodell die Energierechnungen nur Näherungen.

Ausserdem habe ich mal gelernt, dass sich die Schalen zuerst komplett füllen und dann eine neue angefangen wird.
Genau das ist nicht der Fall, wie du ja inzwischen erkannt hast. Bzw. nur bei den ersten beiden Schalen. Und daher darfst du Periode und Schale nicht in einen Topf werfen. Und wieviel Elektronen in eine Schale passen und wieviele drin sind, muss man sauber unterscheiden.
Es gibt verschiedene Unterschalen (Orbitaltypen), und bei jeder Schale kommt ein neuer Typ hinzu. Und bevor ich mit jetzt die Finger wund schreibe, schau dir mal Aufbauprinzip an! Durch die Besetzungsreihenfolge der Schalen und Unterschalen (Madelung-Schema) ergibt sich automatsch der Aufbau des PSE.
Für den unwahrscheinlichen Fall, dass du nicht alles sofort verstehst, kannst du gerne nachfragen. Du kannst auch hier auf GuteFrage stöbern, da habe ich das einige Male erklärt.