%-Massenanteil von zwei Isotopen?
Frage:
Lithium hat die mittlere relative Atommasse 6,941. Es besteht aus einem Gemisch der Isotope 6Li und 7Li mit den relativen Atommassen von 6,015 bzw. 7,016. Berechnen Sie die Massenanteile in %!
Wie kann ich die beiden Massenanteile überhaupt berechnen, wenn ich sie nicht kenne?! Hat jemand eine Idee?
2 Antworten
Setze in eine gleichung ein:
(Faktor 1 * Masseanteil 1 + Faktor 2 * Masseanteil 2) = relative Gesamtmasse
Ja das ist richtig, zu deiner frage: google mal ich bin mir nicht sicher
Das ist etwas schwieriger, als es auf den ersten Blick aussieht. Daher gehen wir am besten in zwei Schritten vor und berechnen erst den Stoffmengenanteil und dann den Massenanteil der beiden Isotope.
Der Stoffmengenanteil läßt sich leicht ausrechnen. Wir haben die Massen der reinen Isotope m₆=6.0151228874 und m₇=7.016003437 und die mittlere Masse m̄=6.941. Wenn wir z.B. 100 Atome haben, dann sind ein paar davon vom Isotop ⁶Li und der Rest sind ⁷Li. Die durchschnittliche Masse ist die Gesamtmasse aller Atome durch die Anzahl der beteiligten Atome, also ein gewichtetes Mittel mit den relativen Häufigkeiten.
Die relativen Häufigkeiten sind aber nichts anderes als die Stoffmengenanteile x₆ und x₇, daher können wir einfach schreiben (weil x₆+x₇=1):


Wir wissen jetzt also, daß z.B. von 1000 Atomen natürlichem Li nur 75 ⁶Li sind und der Rest, also 925, sind ⁷Li.
Der Massenanteil w ist aber etwas anderes: Die 1000 Atome wiegen ja entsprechend der mittleren Atommasse 1000⋅m̄=6941 u. Darunter sind 1000⋅x₆=75 Atome ⁶Li, die wiegen zusammen 1000⋅x₆⋅m₆=451.1 u, also machen sie einen Massenanteil von w₆=6.5% aus, und die ⁷Li entsprechend 93.5%.
Wenn man sich das nicht über 1000 Atome überlegen will, gibt es natürlich auch eine schicke Formel dazu, die einfach die willkürlich gewählte Zahl 1000 wegläßt, weil sich die eh rauskürzt:

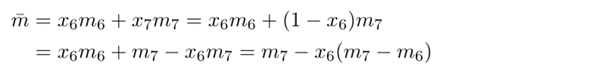

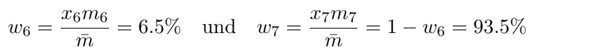
Danke, also ich hab:
7,016x + 6,015y=6,941; mit x+y=1;y=(1-x)
7,016x + (1-x)6,015=6,941, nach x auflösen: x = 0,9251, dh: 7,016 92,15%, 6,015 7,49%
ist das so richtig?
Was mach ich bei mehr als zwei Isotopen? ist das dann überhaupt noch lösbar?