Ammonium Ionen haben einen stärkeren induktiven Effekt als Amine. Dementsprechend kommt es bei Protonen in direkter Nachbarschaft (Bsp. das Methin- Proton bei Alanin) zu einer höheren tieffeldverschiebung. Diese Aussage bestätigen diverse Charakterisierungsangaben von Papern über Aminosäuren.
Moin!
Der Komplex mit der höheren Komplexbildungskonstante ist der stabilere. Die Antowort von dem Community Experten wurde bereits genannt.
Das HSAB Konzept ist eine Tendenz zur Beschreibung der Stabilität von Verbindungen, aber in der Regel recht schwammig. Eine bessere Argumentation ist hier die "Spektrochemische Reihe", welche auf die Orbitalwechselwirkungen eingeht zwischen Zentralatom und Ligand nach Hin und Rückbindungen. Danach ist der Ammin-Ligand ein deutlich stärkerer Ligand als der Chlorido-Ligand und bildet demnach einen stabileren Komplex.
LG
1.) Der Radius des Metalls ist im hs größer als im ls s. https://de.wikipedia.org/wiki/Liste_der_Ionenradien
hs (high-spin) ls (low spin). Es gibt bestimmt auch noch andere Indikatoren, wie höhere Energien, wie du geschrieben hast.
2.) Ab d8 gibt es keinen unterschied mehr bzw. unterscheidet man nicht mehr zwischen hs und ls. Hoffe man kann es anhand der Abbildungen erkennen.
Habe denke ich vergessen zu erwähnen, dass die eg Orbitale zunächst einfach besetzt werden und nicht doppelt. Dann hättest du es bestimmt direkt verstanden.
Ich habe unten auch nochmal eine Folie zu den Spinpaarungsenergien hinzugefügt.
Freut mich, dass ich helfen konnte, obwohl ich die OC lieber mag ;-)
Grüße zurück!




Moin!
Mn(V)O4 3- wäre eine genauere Beschreibung des Ox. Zustanden des Mangans. Außerdem liegt der Komplex in einer tetraedrischen Koordination, mit einer Koordinationsnummer (CN) von 4 vor.
Mangan besitzt also noch 2 d-Elektronen.
Es wird unterschieden zwischen oktaaedrischen und tetraedrischen Ligaandenfeldern (4 O-atome deine Liganden). Wie schon erwähnt handelt es sich hier um ein tetraedrisches Ligandenfeld. Die beiden Felder unterscheiden sich in der aufspaltung der eg und t2g Orbital, wie hier graphisch dargestellt.


Bei der Konfigurationen, also Besetzung der Orbitale, unterscheidet man zwischen high-spin und low-spin Komplexen. zwischen d4-d7. Ich meine sowohl bei teraedrischen als auch bei oktaedrischen Ligandenfeldern, wobei hier nur explizit von oktaedrischen Feldern geredet wird. d1-d3 müssen bei okt. Ligandenfeldern logischer weise Low-spin seien und d8-d10 high-spin. Bei tetraederischen Giganten wäre es d1-d2 low-spin und d6-d10 (nicht ganz sicher) high spin.

Für dein Komplex bedeutet es also, dass die eg orbitale im Low-Spin besetzt sind (2d).
Wenn du jetzt das gesamte MO-Schema von dem Komplex wissen möchtest, muss ich leider passen. Ich kann mir auch nur schwer vorstellen, dass du das in der Tiefe wissen möchtest und dann auf diese Internetseite gehst, die überwiegend für Schüler gedacht sind, um dir eine konkrete Antwort zu erhoffen.
Die Besetzung bezgl. der Liganden wurde im 2. Semester meines Studiums in der AC1 kurz angeschnitten, aber bei weitem nicht verlang das wissen zu können. In der AC 2 kam es auch nicht dran, vielleicht jetzt im Praktikum
oder in der AC3 im 5. Semester. Ich stell hier random ein paar Screenshots rein, bei denen ich hoffe, dass sie dir einwenig weiterhelfen, aber ich gehe nicht drauf ein.




Alter, bin ich der einzige der sich fragt, ob die Menschen hier zusammen mit ihren Geschwistern in ihrer Kindheit in einem dunklen Raum eingesperrt wurden??
Ich finde den Gedanken mit seinen Geschwistern in irgend einer Art und Weise Sex zu haben absolut abartig und widerlich.
Natürlich hat man als Kind mal das Geschlechtsteil seiner Geschwister etwas genauer unter die Lupe genommen, aber zusammen Masturbieren und Sex zu haben ist für mich unvorstellbar und ich bin jetzt wo ich das hier lese sehr dankbar, dass ich nicht solche Erfahrungen gemacht habe.
Also generell verstehe ich nicht ganz, warum der Fußfetisch überhaupt ein Fetisch ist. Ich denke es liegt daran, dass es deutlich mehr ekelige Füße als schöne Füße gibt, bzw. wirklich schöne Füße eine Seltenheit sind. Die Menschen mit ekeligen Füßen sagen natürlich, dass Füße disgusting sind, während Menschen mit schönen Füßen eine neutrale Sichtweise oder eine Vorliebe für Füße haben.
Generell ist die Vorstellung, dass ein Mann, der die Frau tendenziell dominieren soll, an ihren Füßen leckt oder damit rumspielt, nicht attraktiv für Frauen.
Also ich muss sagen, dass es eine tolle Vorliebe ist und man glücklich sein kann, wenn man selber schöne Füße hat.
Also generell würde ich sagen, dass es 80% drauf ankommt, wie man einen Spruch rüberbringt, aber der Spruch ist echt schlecht. Also selbst, wenn sie dich schon klasse finden würde und 2%o im Blut hat, wäre das ein Grund für sie unter den Umständen doch noch abzuhauen haha
Organische Chemie ohne Mechanismen ist wie Fallschirmspringen ohne Fallschirm- es macht kein Spaß.
Also generell:
Jeder verbindet mit HCl eine sehr starke Säure, das alles wegätzt, was ihr in den Weg kommt, dabei ist das natürlich alles stark abhängig von der Konzentration. Genug verdünnt wäre ich auch bereit ein Glas Wasser mit verdünnter HCl zu trinken.
HCl in Kontakt mit Wasser reagiert zu Oxoniumionen, die tatsächlich erst so aggressiv reagieren.
Ich würde einem Menschen nicht empfehlen Klamotten mit HCl zu reinigen, da es deutlich mildere/ schonendere Reinigungsmittel gibt. Polares löst sich in polarem, umpolares in unpolarem. Das gilt auch bei deinen Schuhen.
Ich kann mir vorstellen, dass der Dreck durch die Salzsäure verschwindet, der Schuh aber darunter leidet und Lederschuhe bspw. deutlich schneller spröde werden.
Am ende des Tages ist es eine Chemikalie, die nicht als Reinigungsmittel gedacht ist.

Moin!
Die ersten zwei Reaktionen sind recht bekannte Additionsreaktionen.
Die letzte Reaktion war mir jedoch nicht auf anhieb klar und musste nachlesen. Es scheint, als sei würde es durch die EN-Differenz zwischen von Lithium und Kohlenstoff zu einer Polarisierung kommen, sodass laut Wikipedia das anliegende Kohlenstoffatom „Carbanionische Eigenschaften“ besitzt.
Den Rest habe ich mir zusammengereimt. Es macht im Zusammenhang mit den Additionsreaktionen nur mäßig Sinn diese Reaktion mit hinzuzunehmen, da es einer Nucleophilen Substitution ähnelt nach meiner Darstellung. Ich bin mir daher nicht sicher, ob es so wirklich stimmt.
Trotzdem schonmal ein Anfang ;)
Ich denke ein gutes Beispiel bezüglich der HBB sind in deiner/der Menschlichen DNA.
Die Basenpaare sind über HBB miteinander verknüpft. Ohne die wäre eine Bindung schwer vorstellbar. DNA ist das Grundlegendste von allem Leben und somit auch ziemlich interessant für die Fragestellung. Was sagst du?
Tatsächlich ist die linke Darstellung die gebräuchlichere, wobei Chlorsäure so auch nicht in der Regel dargestellt wird.
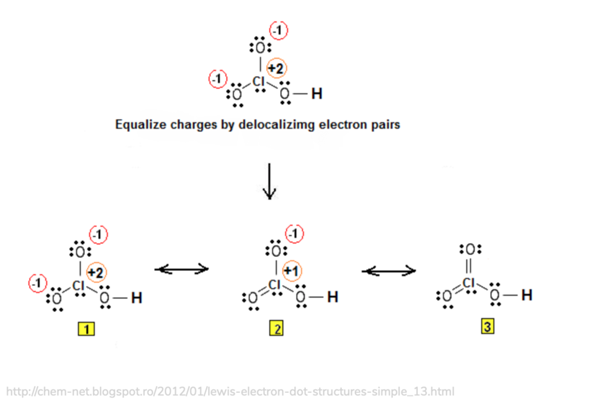
Hier eine Abbildung, auf der du sehen kannst, was ich mit der Darstellungsform meine. Die tatsächliche Darstellungsweise ist die 3, beider das Molekül keine Ladungen oder Partialladungen trägt.
Vielleicht hilft dir das erstmal weiter und du kannst dir ein paar Dinge erschließen?
Du kannst auch in einem pinken Tütü, halbnackt, durch die Stadt gehen, es kommt nur darauf an, wie sehr du das Outfit "rockst" und wie wohl du dich dabei fühlst. Solange du das Ausstrahlst, werden die die Leute dafür auch "feiern". Solange dein Selbstbewusstsein groß genug ist, kannst du so ziemlich alles machen.
Beste Grüße
Lenny
Ich hoffe, dass die Folien dir einwenig weiterhelfen!
Die ersten zwei Folien zum Verständnis, welche Verbindungen als Aromaten bezeichnet werden und die letzte Folie um ein Gefühl für Mesomerie zu bekommen (hier anhand der elektrophilen aromatische Substitution, ein Mechanismus, den du noch nicht kennen musst), wobei das bestimmt auf YouTube nochmal besser erklärt wurde.
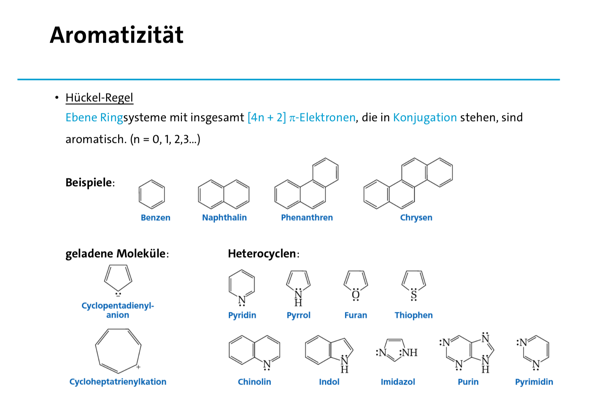
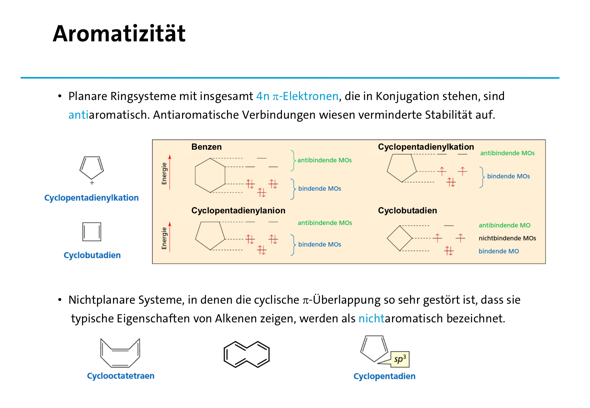
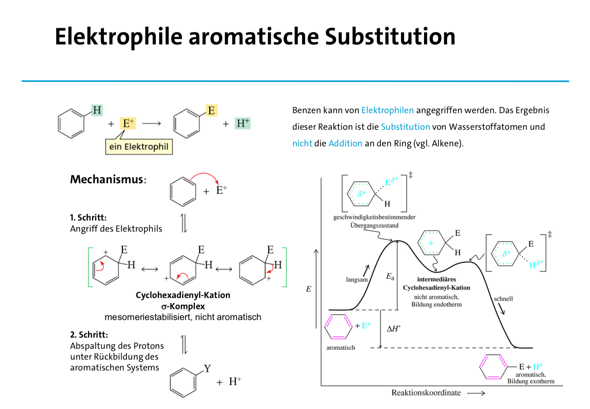
Beste Grüße
Lenny
Hier zur Übersicht.

Schönes Arbeitsblatt!
Ich hoffe, dass die Doppelbindungen deutlicher zu erkennen sind als hier. auf dem Bild, aber ansonsten schön!
Hallo :-)
Du hast bis jetzt auf deinem Zettel Ethan und Ethanol aufgezeichnet.
Der Lehrer möchte wissen, die die Ox. Zahlen von den Molekülen aussehen, die entstehen, wenn ethanol oxidiert wird.
Fallen dir zufällig 2 Moleküle ein, die durch Oxidation. von Ethanol als Ausgangsstoff entstehen können?
Oder anders gefragt, was für eine Stoffklasse entsteht, wenn man Alkohole oxidiert? Was für eine Stoffklasse entsteht, wenn man wiederum diese Stoffklasse oxidiert?
Die Formel, die dir weiterhilft lautet n=cxV
Du kannst die Stoffmenge (n) von HCl berechnen und die beiden Stoffmengen gleichsetzten, dann stellst du nach c um und bekommst dein Ergebnis.
Frag gerne nach, falls was. unklar gewesen sein sollte.
Capronsäure, Milchsäure, Isovaleriansäure :P
Ist das schlecht erklärt, ich weine innerlich.
Was für dich wahrscheinlich ausreichen zu wissen ist:
H-Atome haben generell in der organischen Chemie eine Ox. Zahl von +I
O-Atome haben meist (in der Schule immer) eine Ox. Zahl von -II
Mehr Verbindungen als Kohlenstoff (C), Wasserstoff (H) und Sauerstoff (O), wirst du in der Schule denke ich in Bezug auf Ox. Zahlen nicht behandeln.
Die Ox. Zahl der Kohlenstoff-Atome ergibt sich immer aus der Summe der Ox. Zahlen der anliegenden Verbindungen:
Ethanol als bsp.: H3C-CH2-OH
Die Hs haben eine Ox. Zahl von +1, also hat das erste C-Atom eine Ox.Zahl von -III, um die +III auszugleichen.
Das anliegende C-Atom beeinflusst die Ox. Zahl nicht, da diese den gleichen EN-Wert (Elektronegativitätswert) besetzten. Das Zweite C-Atom besitzt eine Ox. Zahl von -1.
Die beiden Hs +I= +II // O besitzt eine Ox. Zahl von -II und das H am O nochmal +I
Das ergibt zusammen +II + (-II) + +I= +I um das auszugleichen, da das Molekül insgesamt neutral geladen ist, besitzt die Ox. Zahl von -I.
Bei einer Carbonsäure wie in deinem Beispiel ist es genau das selbe.
Google mal die Verbindungen: Malonsäure, Oxalsäure und Ethylenglycol und versuch die Ox. Zahlen zuzuordnen.
Bei Fragen gerne schreiben ! Beste. Grüße Lenny :)