Stöchiometrisches Rechenbeispiel (Volumetrie)?
Folgendes Beispiel:
Eine H3BO3-Lsg enthält 50g/l H3BO3. Wie viel ml dieser müssen in einem 500ml Messkolben verdünnt werden, damit 15ml dieser Verdünnung vorgelegt werden und dafür 25ml 0,2M NaOH verbraucht werden.
Ich hätt mit neq(H3BO3) = neq(NaOH) erstmals die Konz. der Verdünnung ausgerechnet (=0,1111 mol/l H3BO3)
die 50g/l in c mit M(H3BO3) umgewandelt = 0,8087 mol/l
und nun besteht nur noch die Aufgabe auszurechnen wie viel ml der 0,8087M in diesen Kolben gehören um nach auffüllen eine 0,111M zu erhalten...
Da hätt ich mit der Schlussrechnung;
0,1111M --> 0,5l
0,8087M --> xl (indirekt)
x = 0,06869l oder auch 68,69 ml H3BO3-Lsg herausbekommen...
Im Lösungsheft steht aber 206,0ml das Ergebnis wären, diese stimmt aber nicht immer :O
Ist mein Ergebnis richtig ? (Ich komm mit einem anderen Rechenweg auf das Lösungsheft-Ergebnis, aber da muss ich ohne Grund /2 rechnen)
1 Antwort
Borsäure ist eine einbasige Säure:
B(OH)₃ + 2 H₂O ⟶ H₃O⁺ + B(OH)₄⁻
Die Molare Masse beträgt M=61.84 g/mol, Deine Lösung hat eine Massenkonzentration von γ=50 g/l bzw. eine Stoffmengenkonzentration von c=γ/M=0.81 mol/l.
Nun willst Du eine Borsäurelösung haben, die von 25 ml 0.2 mol/l NaOH genau neutralisiert wird. Das entspricht einer Stoffmenge NaOH von n=c⋅V=5 mmol, und die Stoffmenge an Borsäure muß natürlich gleich groß sein, weil die lt. Reaktionsgleichung 1:1 miteinander reagieren.
Also muß die Borsäure-Lösung in 15 ml 5 mmol B(OH)₃ enthalten, bzw. c=n/V=0.33 mol/l. Diese Lösung soll in einem 500-ml-Maßkolben hergestellt werden; der ganze Maßkolben muß dann also n=c⋅V=167 mmol B(OH)₃ enthalten.
Die Stammlösung hat also, wie wir am Anfang gesehen haben, 0.81 mol/l, wir brauchen genau V=n/c=206 ml, die wir mit Wasser auf 500 ml auffüllen, dann nehmen davon 15 ml und titrieren mit der NaOH.
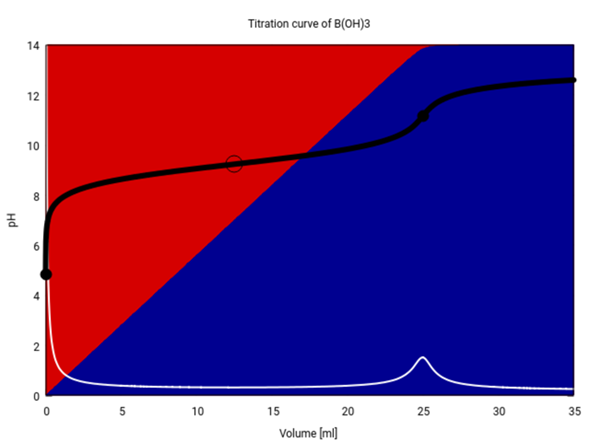
Zum Abschluß zeige ich Dir noch die Titrationskurve von 15 ml 0.33333 mol/l B(OH)₃ mit 0.2 mol/l NaOH. Die sieht eher unspektakulär aus, weil Borsäure sehr schwach ist und daher keinen ordentlichen Sprung am Äquivalenzpunkt hinkriegt. In der Praxis würde man das daher nicht so titrieren.

Ich weiß weder, was neq noch was z heißen soll. Was auch immer Du Dir vorstellst: Entweder erkläre es systematisch, dann schaue ich mir an, ob der Rechengang valide ist, oder rechne es auf Deine Art durch — Du weißt ja jetzt, was rauskommen muß.
Ok danke, aber warum kann ich nicht mit neq(H3BO3) = neq(NaOH) die Konz. der verdünnten Borsre ausrechnen ? Es käme das gleiche raus, wenn ich nicht z = 3 von der Borsäure hätte sondern ich mit z = 1 rechnen würde... ist es 1 ?