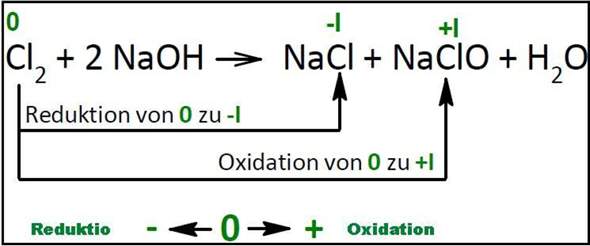
Redoxreaktion und oxidationszahlen?

Wir müssen diese Aufgabe bearbeiten und ich bin mir nicht ganz sicher wie das funktionieren soll, ich weiß dass die oxidationszahl nach der Reaktion aussagt ob es eine redoxreaktion ist oder nicht, aber irgendwie komme ich bei C und D nicht weiter.. LG
1 Antwort
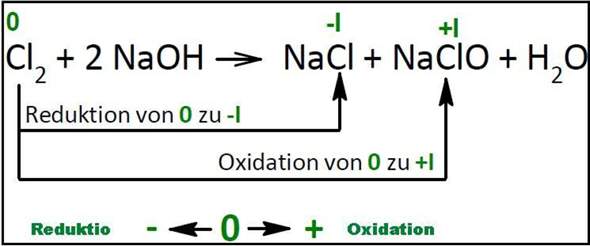
Es gibt eine einfache "Eselsbrücke":
Du bestimmst die Oxidationszahlen und stellst Dir diese auf einem Zahlenstrahl vor. Wird die Oxidationszahl kleiner - wandert also auf dem Zahlenstrahl nach links - dann handelt es sich um eine Reduktion. Wird die Oxidationszahl hingegen größer - wandert also auf dem Zahlenstrahl nach rechts - dann handelt es sich um eine Oxidation.
Die chemisch exakte Definition lautet:
"Als Oxidation bezeichnet man die Teilreaktionen, bei der ein Atom, Molekül oder Ion Elektronen abgibt. Dem gegenüber steht die Reduktion, bei der ein Reaktionspartner ein oder mehrere Elektronen aufnimmt."
So viele Elektronen, wie auf einer Seite abgegeben werden, müssen auf der anderen Seite auch wieder aufgenommen werden. Anderenfalls wäre das Endprodukt instabil, d.h. nach außen nicht mehr elektrisch neutral - es würde zerfallen! Daraus resultiert, dass die Summe aller Oxidationszahlen in einer Redoxreaktion immer Null (neutral) ergeben muß!