Ph Wert ändern durch Zugabe von Säure… Frage zu Aufgabe?
s.Abb
Der korrekte Ansatz in den Lösungen ist es die Konzentration der Milchsäure zu berechnen und dann über die Formel für schwache Säuren auf den PH Wert zu schließen. Allerdings stell ich mir die Frage warum die Oxoniumionen der neutralen Lotion (10^-7) da nicht einberechnet werden?

1 Antwort
Die m=5 g Milchsäure entsprechen einer Stoffmenge von n=m/M=0.555 mol, und in 355 ml Lösung ergibt das c=n/V=0.156 mol/l. Jetzt müssen wir nur noch den pH-Wert einer solchen Lösung berechnen. Ich nehme dazu meine Spezialformel
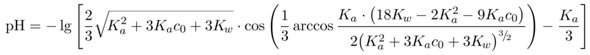
aber Du kannst auch etwas Billigeres verwenden, z.B. pH=½(pKₐ−lg c). Mit pKₐ=3.86 kommt jedenfalls 2.34 heraus.
Die Rechnung modelliert die „Reinigungslotion mit pH=7“ als reines Wasser. In der Praxis könnten natürlich puffernde Substanzen (z.B. Phosphate) enthalten sein, die den pH gegen Säurezugabe stabilisieren, so daß irgendetwas zwischen 3.34 und 7 herauskommt.