Neutralisationstitration?
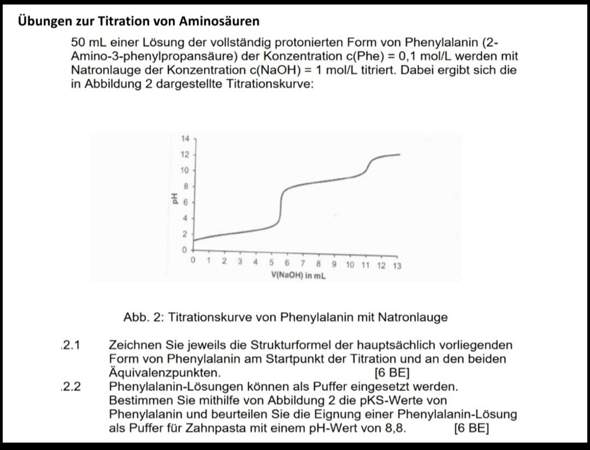
Heyho, ich bräuchte mal eure Hilfe bei diesen beiden Aufgaben. Ich finde dazu absolut nichts im Internet. Danke schonmal im vorraus!
1 Antwort
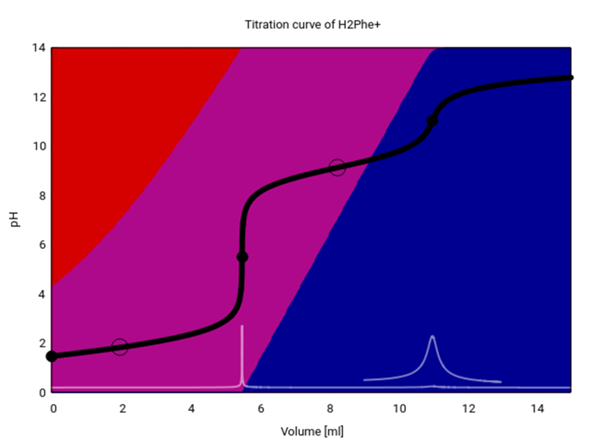
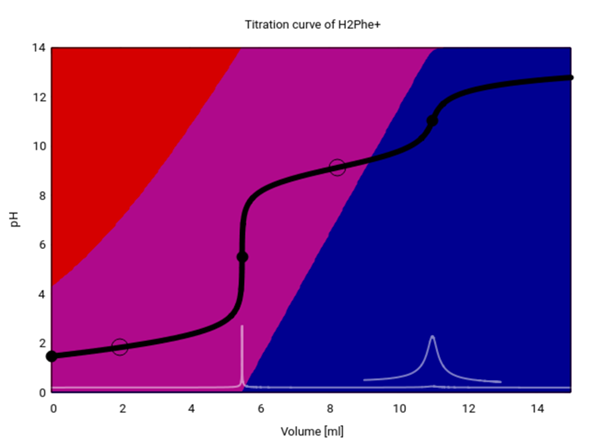
Sehen wir uns die Titrationskurve in größerem Detail an. Dazu habe ich sie berechnet mit c=0.11 mol/l, pK₁=1.83 und pK₂=9.13.
Du siehst hier nicht nur die Titrationskurve (schwarz), sondern auch ihre erste Ableitung (weiß) und die Speziesverteilung, also die relativen Anteile der verschiedenen Protonierungsstufen:
- Rot ist das Kation CH₃–CH(C₆H₅)N⁺H₃–COOH. Das ist die vollständig protonierte Form, die in den Titrierkolben eingewogen wurde (c=0.11 mol/l). Weil das Ding eine mittelstarke Säure ist, ist sie zu einem guten Teil (31%) dissoziiert, und der pH ist entsprechend niedrig auf 1.47.
- Violett ist das Zwitterion CH₃–CH(C₆H₅)N⁺H₃–CO₂¯. Bis zum ersten Äquivalenzpunkt (V=5.5 ml, pH 5.51) bildet sich immer mehr davon, und am Weg zum zweiten Äquivalenzpunkt (V=11 ml, pH=11.04) wird es dann wieder verbraucht.
- Blau ist das Anion CH₃–CH(C₆H₅)NH₂–CO₂¯. Es bildet sich zwischen dem ersten und zweiten Äquivalenzpunkt, und danach ist es praktisch die einzige Spezies in der Lösung.
Zwischen dem ersten und zweiten Äquivalenzpunkt liegt ein Pufferbereich, in dem der pH in der Nähe des pK₂ herumgurkt und sich bei Basenzugabe nicht stark ändert; der Ring bei V=8.25 genau in der Mitte zwischen den beiden Äquivalenzpunkten markiert den Pufferpunkt, an dem pH=pK₂ (es liegen je 50% Zwitterion und Anion vor). Der gefragte pH=8.8 ist nicht weit vom pK₂ entfernt (in der Titrationskurve bei V=7.25 ml) und liegt daher noch im Pufferbereich (grob pK₂±1).
Es gibt auch einen Pufferpunkt in der ersten Hälfte der Titration, aber der ist nicht so gut zu sehen; er liegt nicht genau bei halbem Verbrauch zum Äquivalenzpunkt, sondern etwas früher (V=1.98 ml), weil das Phenylanalin ja bereits in der Ausgangslösung merklich dissoziiert ist und der 1:1-Punkt daher schon vor der Halbwegsmarke erreicht wird.
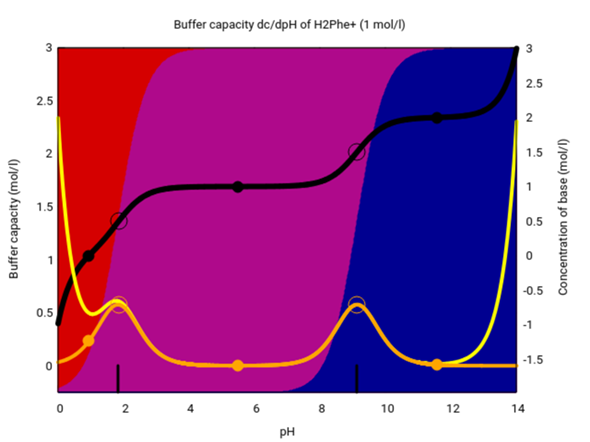
Die Pufferfähigkeit von Phenylalanin können wir uns auch in einem etwas anderen Plot ansehen. Dazu zeichne ich die Speziesverteilung einer 1 mol/l Lösung im ganzen pH-Bereich, von 0 bis 14. Die schwarze Kurve gibt an, wieviel Base man zugeben muß, um genau diesen pH zu erreichen, und die gelbe zeigt die Pufferkapazität der Lösung.
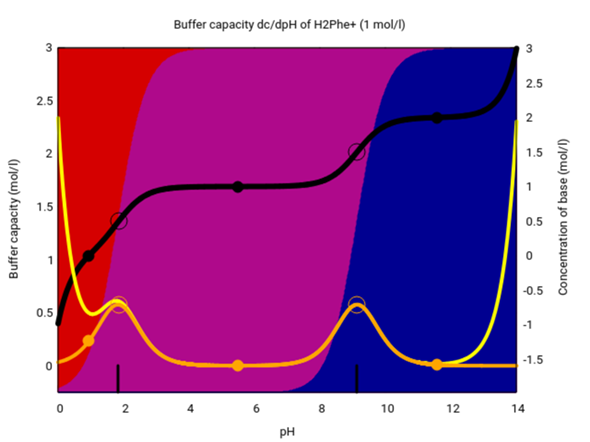
Der Anteil der Pufferkapazität, der aufs Phenylalanin zurückgeht, ist orange eingezeichnet. Du siehst zwei Maxima genau um die pKₐ-Werte. Der Pufferpeak bei ungefähr pH≈9 deckt auch pH=8.8 einigermaßen ab; bei pH=8.8 bekommen wir eine Pufferkapazität von 0.5 pH-Einheiten pro mol zugesetzte Säure oder Base; das ist nicht viel kleiner als die 0.58 am Maximum bei pH=pK₂=9.13. Phenylalanin ist also als Puffer gut geeignet in diesem pH-Bereich.