Hat jemand eine relativ simple Erläuterung der Aggregatzustände und deren Übergänge auf Teilchenebene?
Dankeschön!
4 Antworten
In Eis (festem Wasser) hängen alle Wassermoleküle starr aneinander. Die (Wärme-)Energie (je Wassermolekül) reicht nicht, diese (Kristall-)Bindungen aufzureißen.
In flüssigem Wasser reicht die Wärmeenergie (je Wassermolekül) aus, die (starren) Bindung zu Kristallen aufzureißen, aber nicht, die (schnell wechselnden) Bindungen zwischen den Wassermolekülen in Bewegung.
In Wasserdampf ist die Energie groß genug, auch diese Bindungen zu zerrreißen.
Interessant sind die Zustände, wo sich zwei (oder mehrere) Aggregatzustände den Raum friedlich teilen.
Bei schmelzendem Eis / gefrierendem Wasser ist die Wärmeenergie (je Wassermolekül) gerade so groß, dass sie die Kristallbindung gerade aufreißen kann. Denkbar wäre natürlich auch ein Zwischenzustand zwischen fest und flüssig, also knetbar, streichzart o. ä., wie es bei Wachsen, Gläsern und vielen anderen Substanzen auch tatsächlich der Fall ist.
Aber bei Wasser ist dieser "halb-gebundene" Zustand energiereicher (genauer: enthalpiereicher) als die Koexistenz flüssigen und gefrorenen Wassers. Also teilt sich das Wasser in diese beiden auf. Wegen der Energieerhaltung so, dass die Gesamtenergiebilanz stimmt.
Ebenso ist es beim Übergang flüssig - gasförmig.
Etwas komplizierter wird es beim Tripelpunkt (alle drei Aggregatzustände koexistieren) und erst recht beim kritischen Punkt (der Unterschied zwischen flüssig und gasförmig verschwindet). Aber das werde ich bei Bedarf ein andermal anschaulich zu machen versuchen, nicht in dieser Antwort.
Je mehr Energie (also Wärme) ein Teilchen hat, desto mehr bewegt es sich und desto größer müssen die Abstände zwischen den Teilchen eines Stoffes sein. Ist es also kalt (wenig warm) brauchen die Teilchen weniger Platz und können somit enger zusammen sein (die Dichte ist also größer). Ist es sehr warm, brauchen die Teilchen viel Platz und die Dichte ist somit geringer. Die Aggregatzustände ergeben sich dann aus der räumlichen Anordnung der Teilchen: fest - die Atome (Teilchen) sind in einem festen Gitter angeordnet, flüssig - die Atome sind nicht geordnet, jedoch immernoch lose verbunden, gasförmig - die Atome schwirren relativ frei im Raum herum.
Ganz einfach:
Umso höher die Temperatur wird umso mehr wollen die Teilchen außeinander gehen. Bei wasser musst du beachten, dass wasser im kalten und im warmen zustand bzw. im festem und im gasförmigen zustand sich ausbreitet, das Volumen des wassers ist bei 4 grad C am kleinsten.
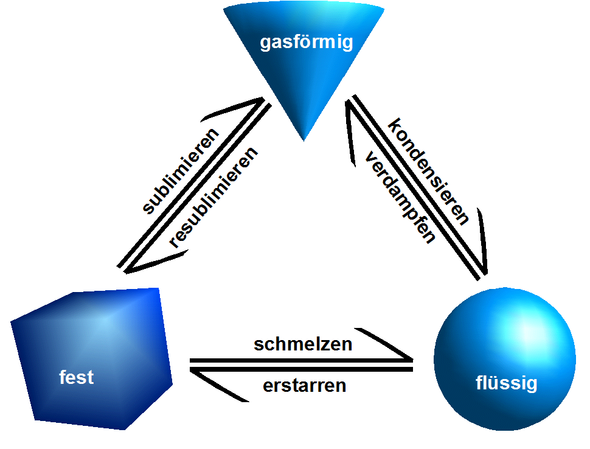
Übergänge:
Fest --> Flüssig= Schmelzen
Flüssig --> Gasförmig= Verdampfen
Gasförmig --> Flüssig = Kondensieren
Flüssig --> Fest = Erstarren
Gasförmig --> Fest = Resublimieren
Fest --> Gasförmig = Sublimieren
Bei weiteren fragen kannste mich anschreiben: Sebastian042901@gmail.com
Hey, vielen Dank für deine Erklärung! Kennst du dich mit der Diffusion auf der Teilchenebene auch aus? Wenn ja könntest du es mir ja vielleicht auch erklären.
vllt hilft dir das