Frage Chemie?
Hi, ich versteh das nicht :( kann mir das jmd erklären? Also ich habe die Oxidationszahlen geschrieben. Von der propan-2ol- Säure das erste C Atom hat ja 3. das zweite hat 0. und das dritte -3.
und dann beim co2 hat es ja c atom plus vier. Und beim Ethanal hat bei der Aldehyd Gruppe eins
das andere c hat dann -3. jetzt gibt es aber viele Oxidationen ? In einer redoxgleichung oder wie? Oder hab ich mich bei den oxidationszahlen vertan?
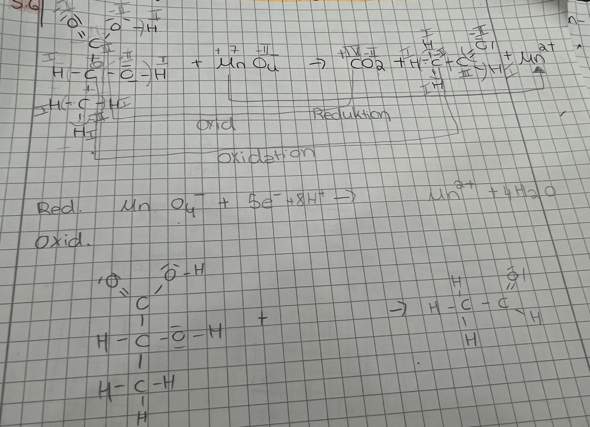
3 Antworten

Moin,
ja, hier findet eine Oxidation von zwei verschiedenen Kohlenstoffatomen im sauren Milieu statt, wobei es sogar zu einer C–C-Bindungsspaltung kommt.
Die Bruttogleichung lautet:
5 CH3–CH(OH)–COOH + 2 KMnO4 + 3 H2SO4 ---> 5 CH3–CHO + 5 CO2 + 8 H2O + 2 MnSO4 + K2SO4
2-Hydroxypropansäure (Milchsäure), Kaliumpermanganat und Schwefelsäure reagieren zu Ethanal (Acetaldehyd), Kohlenstoffdioxid, Wasser, Mangansulfat und Kaliumsulfat.
Die Oxidationsstufen hast du korrekt bestimmt. Das C-Atom der Carboxygruppe hat die Oxidationszahl (OZ) +III. Das C-Atom mit der Hydroxygruppe hat die OZ 0.
Mangan im Permanganation hat die OZ +VII. Das Mangankation hat am Ende die OZ +II.
Dabei handelt es sich also um eine Redoxreaktion, weil einerseits Kohlenstoffatome oxidiert werden (die eine Sorte von einer Carboxygruppe zu Kohlenstoffdioxid, die andere von einer Hydroxy- zu einer Aldehydgruppe). Dabei erhöht sich die OZ in beiden Fällen um +1 (einmal von +III auf +IV und das andere Mal von 0 auf +I).
Andererseits wird das Mangan im Permanganat von der OZ +VII zum Mangan-II mit der OZ +II reduziert.
Wenn du also die Bruttogleichung von allem befreist, was nichts mit der Redoxreaktion zu tun hat, bleibt folgendes Redoxsystem übrig:
Oxidationsteilgleichung: C+III + C0 ---> C+IV + C+I + 2 e–
Reduktionsteilgleichung: Mn+VIIO4– + 5 e– + 8 H3O+ Mn2+(+II) + 12 H2O
Jetzt musst du wegen der Elektronenneutralität die Oxidationsteilgleichung mit 5 und die Reduktionsteilgleichung mit 2 multiplizieren, dann hast du's...
LG von der Waterkant
Es scheint, als ob du versuchst, die Oxidationszahlen von verschiedenen Atomen in verschiedenen Molekülen zu bestimmen. Die Oxidationszahl ist ein imaginärer Wert, der angibt, wie viele Elektronen ein Atom in einer Verbindung abgegeben oder aufgenommen hat.
Für die Propan-2ol-Säure ist es wichtig zu beachten, dass die Oxidationszahl des Kohlenstoffatoms, das der Carbonsäuregruppe am nächsten liegt, +3 beträgt, da dieses Kohlenstoffatom drei Bindungen zu anderen Atomen und eine Bindung zu einer Hydroxylgruppe hat, die als ionische Bindung angesehen werden kann. Das Kohlenstoffatom in der Mitte hat eine Oxidationszahl von 0, da es von vier gleich elektronegativen Atomen umgeben ist (zwei Kohlenstoffatome und zwei Wasserstoffatome). Das Kohlenstoffatom am anderen Ende hat eine Oxidationszahl von -3, da es von drei Wasserstoffatomen umgeben ist.
Bei CO2 hat das Kohlenstoffatom eine Oxidationszahl von +4, da es von zwei Sauerstoffatomen umgeben ist, die stärker elektronegativ sind als Kohlenstoff und daher die Elektronenpaare in der Bindung zu sich ziehen. Beim Ethanal hat das Kohlenstoffatom in der Aldehydgruppe eine Oxidationszahl von +1, da es von einem Sauerstoffatom und einem Wasserstoffatom umgeben ist und somit eine ionische Bindung eingeht. Das Kohlenstoffatom in der Methylgruppe hat eine Oxidationszahl von -3, da es von drei Wasserstoffatomen umgeben ist.
Redoxreaktionen beinhalten die Übertragung von Elektronen zwischen verschiedenen Atomen in einer Reaktion. Die Kenntnis der Oxidationszahlen ist ein wichtiger erster Schritt bei der Bestimmung, ob eine Reaktion eine Redoxreaktion ist oder nicht. Es ist jedoch nicht notwendig, um eine Redoxreaktion durchzuführen.
Ich hoffe es hilft dir!

propan-2ol- Säure
Davon habe ich echt noch nie was gehört, aber:
Oxidation ist per Definition die Reaktion mit Sauerstoff, bzw die Abgabe von Elektronen.
Stell dir einfach erst mal vor, alle C-C und C-H Bindungen sind 0 und Sauerstoff ist immer -2, Wasserstoff ist +1
In Methan CH4 ist die Ox-Zahl also 0
Methanol CH3-OH ist die Ox-Zahl des C also +1
Methanal CH2=O ist die Ox-Zahl des C also +2
Methansäure HCOOH ist die Ox-Zahl des C also +3
Kohlendioxid O=C=O ist die Ox-Zahl des C also +4
So macht die Betrachtung der Oxidation von Kohlenwasserstoffen den meisten Sinn. Gleichzeitig wird das Oxidationsmittel (Permanganat) logischerweise selbst reduziert.
Wenn ihr bei euch in der Schule die C-H Bindungen mit dazuzählt (C-C Bindungen werden eigentlich überall als 0 betrachtet), macht das die Sache zwar etwas komplexer, die oben gezeigte Idee bleibt aber (mit anderen Zahlen) gleich.
m.f.G.
anwesende