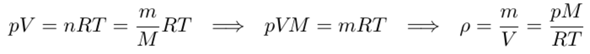Dichte bei Gasen ( Chemie)?
siehe Bild:
die beiden unteren Fragen verstehe ich nicht, Recherche bringt leider auch nix!
Dringende Hilfe !
Danke im Voraus 😊

4 Antworten

Gase dehnen sich mit steigender Temperatur aus, d.h. die Dichte nimmt ab und umgekehrt. Doch die Anomalie scheint sich auf Wasser zu beziehen?
Normalerweise dehnt sich eine Flüssigkeit mit steigender Temperatur aus, d.h. die Dichte nimmt ab (Teilchen brauchen mehr Platz). Bei sinkender Temperatur zieht sich die Flüssigkeit zusammen und die Dichte nimmt zu.
Wasser hat eine Anomalie. Von 0 Grad (Schmelzpunkt) bis 4 Grad nimmt die Dichte zu und erst ab 4 Grad nimmt die Dichte wieder ab, wie es eigentlich normal wäre. Das liegt an der Anordnung der Wassermoleküle unmittelbar nach dem Schmelzpunkt.

Kannst du mal fragen, was deine Lehrerin da geraucht hat? In der Aufgabenstellung ist doch eindeutig nach der Dichteänderung eines Gases gefragt. Die Dichteanomalie, die sie da anspricht, ist aber die Dichteanomlie des Wassers und Wasser ist bei 4°C nicht gasförmig. Außerdem hat die Dichteanomalie dabei auch überhaupt nichts zu suchen.
Aber zu deiner eigentlichen Frage: Schau dir mal die Ideale Gasgleichung an. Da wird eine Verbindung sichen Druck, Volumen und Temperatur eines idealen Gases aufgezeigt

In der Aufgabe scheint nach der Dichte von Gasen gefragt zu werden, daher hat flüssiges Wasser mit seiner Dichteanomalie nichts mit der Frage zu tun.
Die Dichte ist ρ=m/V, und alle idealen Gase gehorchen der Gleichung pV=nRT, und zur Umrechnung zwischen Masse und Stoffmenge verwenden wir n=m/M. Damit bekommt man:
Damit wissen wir, daß die Dichte direkt proportional zum Druck ist (doppelter Druck, doppelte Dichte; halber Druck, halbe Dichte), aber indirekt proportional zur Temperatur (halbe Temperatur, doppelte Dichte etc), zumindest wenn bei der Zustandsänderung das Gas auch wirklich gasförmig bleibt.

Da bin ich wieder einmal an einer Formel gescheitert, daher kommt die Antwort nochmals mit Formelbild.

In der Aufgabe scheint nach der Dichte von Gasen gefragt zu werden, daher hat flüssiges Wasser mit seiner Dichteanomalie nichts mit der Frage zu tun.
Die Dichte ist ρ=m/V, und alle idealen Gase gehorchen der Gleichung pV=nRT, und zur Umrechnung zwischen Masse und Stoffmenge verwenden wir n=m/M. Damit bekommt man:
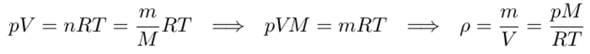
Damit wissen wir, daß die Dichte direkt proportional zum Druck ist (doppelter Druck, doppelte Dichte; halber Druck, halbe Dichte), aber indirekt proportional zur Temperatur (halbe Temperatur, doppelte Dichte etc), zumindest wenn bei der Zustandsänderung das Gas auch wirklich gasförmig bleibt.