Wie ist die Löslichkeit von Ag3PO4 in 1 molarer Na3PO4-Lösung?
Wie berechnet man diese aufgabe
Wie berechnet man diese Aufgabe?
2 Antworten
Dazu braucht man ein Lösungsprodukt von Ag₃PO₄. Google sagt Kₛₚ=8.89⋅10⁻¹⁷ mol⁴/l⁴ und ich rechne jetzt damit, egal ob es stimmt oder nicht.
3 Ag⁺ + PO₄³⁻ ⟶ Ag₃PO₄
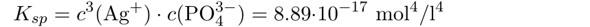
In unserer Lösung (1 mol/l Na₃PO₄) treiben sich jede Menge Phosphationen herum, deren Menge wird sich nicht ändern, wenn ein bißchen Ag₃PO₄ zusätzlich gelöst werden. Dagegen stammen alle Ag⁺-Ionen aus dem Silberphosphat; wenn sich x mol Ag₃PO₄ pro Liter Suppe lösen, dann beträgt c(Ag⁺)=3x
Dann brauchen wir nur noch die Phosphationenkonzentration und können die Gleichung auflösen. Man könnte annehmen, c(PO₄³⁻)=1 mol/l, aber das stimmt nicht ganz, weil Phosphat eine mittelstarke Base ist und zum Teil nach
PO₄³⁻ + H₂O ⟶ HPO₄²⁻ + OH⁻
dem Wasser Protonen klaut. Um auszurechnen, wieviel Phosphat in der Lösung enthalten ist, müssen wir die Basenkonstante für das Phosphat kennen. Dazu schlagen wir die dritte Säurekonstante für H₃PO₄ nach (pKₐ=12.32) und berechnen daraus nach pKb=14−pKₐ die gewünschte Basenkonstante: Kb=0.021 mol/l. Nun setzen wir an, daß y mol pro Liter des Phosphats nach der Gleichung abreagieren und dabei je y mol pro Liter OH⁻ und HPO₄²⁻ ergeben; die Phosphatkonzentration ist dann c₀−y, wobei c₀ die nominale Konzentration von 1 mol/l ist.
Wir setzen ins Massenwirkungsgesetz ein und lösen nach y auf (ahoi, quadratische Gleichung voraus!):
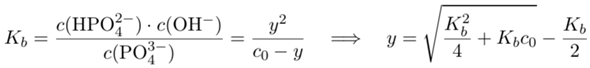
und erhalten y=0.13 mol/l bzw. c(PO₄³⁻)=c₀−y=0.87 mol/l. Damit gehen wir ins Lösungsgleichgewicht und lösen nach x auf:
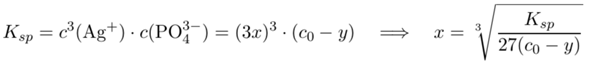
Die Lösung ist x=1.56 µmol/l, und das sollte (bei Abwesenheit von Rechen- oder Denkfehlern meinerseits) die richtige Antwort sein.
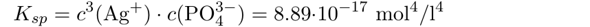
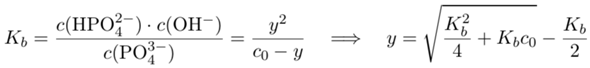
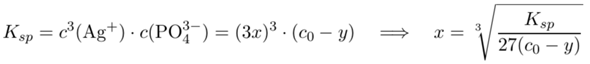
Lies dir dazu mal Texte zum gleich-ionigen und fremd-ionigen Zusatz durch: