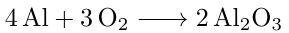Berechne die Masse an Aluminium zur Herstellung von 300 g Aluminiumoxid?
1 Antwort

Bevor wir mit der eigentlichen Rechnung beginnen können, stellen wir die Reaktionsgleichung auf, die uns die vorliegenden Stoffmengenverhältnisse darlegt.
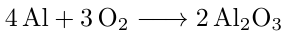
Aus dieser Reaktionsgleichung geht hervor, dass 4 Mol Aluminium für die Synthese von 2 Mol Aluminiumoxid benötigt werden. Folglich muss die aufgewendete Stoffmenge an Aluminium doppelt so groß sein, wie die des entstandenen Aluminiumoxids.
Mithilfe der molaren Masse des Aluminiumoxids, die wir mithilfe des Periodensystems der Elemente berechnen können, und der gegebenen Masse von ebendiesem, berechnen wir die Stoffmenge des vorliegenden Aluminiumoxids.
Mithilfe der Reaktionsgleichung, aus der hervorgeht, dass die Stoffmenge des aufgewendeten Aluminiums doppelt so groß ist, wie die Stoffmenge des entstandenen Aluminiumoxids, kann nun die Masse des Aluminiums berechnet werden. Dabei wir wieder die molare Masse von ebendiesem berechnet.
Folglich müssen circa 158.824 Gramm Aluminium aufgewendet werden.
~Johannes