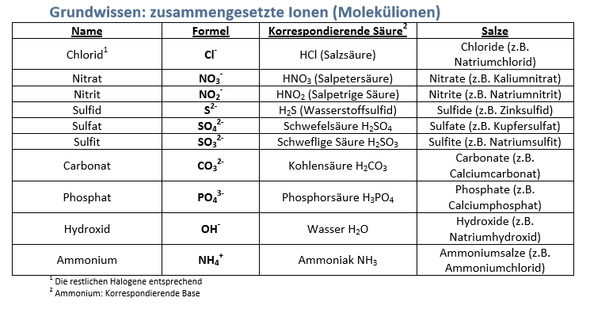
Sind bei zusammengesetzten Ionen die jeweiligen Elemente auch ionisiert oder nur eines davon?
Hallo, siehe dazu die Tabelle und wir nehmen als Beispiel Nitrat. Ist dann das N selbst ionisiert? Ich denke nicht. Wenn das nicht ionisiert ist, warum heißt dann die Überschrift zusammengesetzte Ionen? Das sind dann keine Zusammengesetzte Ionen sondern das ist die Zusammensetzung eines neutralen Elements mit einem Ionisieten Teilchen.
Kann mir wer helfen?
3 Antworten

Deine Überlegungen sind im Grunde richtig. Das fehlende bzw. überschüssige Elektron ist meist nicht klar einem Atom des Molekülions zuzuordnen. Schuld daran ist z.B. die Mesomerie, aber auch die Polarisierung von Bindungen, die eine bindende Ladungswolke verlagert. Es bleibt die Zuordnung von "Partialladungen", die m.o.w. rechnerisch verteilt werden.
Im Sulfat geht man z.B. heute von 4 negativen Partialladungen an den Sauerstoffatomen aus, dazu zwei positive am Schwefel. Beim Hydroxid ist es klarer: Der Sauerstoff hat ein Elektron zuviel, trotzdem bindet es ein H kovalent.

Ein Ion ist ja einfach nur ein geladenes Atom oder Molekül. Bei Atomen ist es einfach: Es fehlen Elektronen oder es gibt zu viele auf der Valenzschale.
Bei ionisierten Molekülen kannst du nicht einfach so pauschal sagen, wo welche Ladung ist, wie du am Beispiel des Nitrations auch sehen kannst https://de.wikipedia.org/wiki/Nitrate#Struktur). Es gibt Mesomerie. Aber das Prinzip bleibt: entweder zu viele Elektronen oder zu wenige. Hier hast du nur Anionen (außer NH4+), also zu viele Elektronen, aber wo genau die sind kann man oft nicht wirklich mit einer Formel darstellen.

Die Tabelle hat, bezogen auf die Überschrift "zusammengesetzte Ionen - Molekülionen" auch noch zwei Falschangaben:
- Halogenide sind nicht zusammengesetzt.
- Sulfide sind nicht zusammengeetzt.
Dafür fehlen die die folgenden Kategorien:
- Hypochlorit ClO(-)
- Chlorit ClO2(-)
- Chlorat ClO3(-)
- Perchlorat ClO4(-)
(entsprechend für die anderen Halogenide).
Hier nimmt das Halogenatom unterschiedliche Oxidationsstufen an:
+ I, + III, + V und + VII.
Zusammengesetzte Ionen sind Moleküle, also Verbindungen mit kovalenten Bindungen, die in ihrer Gesamtheit zuviele oder zuwenig Elektronen haben, so dass sie nach außen hin geladen sind.

Einem einzelnen Atom kann man die Ladung nur zuweisen, wenn man die Oxidationszahlen betrachtet - das ist dann aber nur eine "Formalladung".
Sauerstoffsäuren des Fluors existieren vermutlich nicht, immerhin scheint man inzwischen Hypofluorit (FO^-) nachgewiesen zu haben.
Danke