Löslichkeitsprodukt PbCl2?
Hallo,
Wir sollen als Hausaufgabe das Löslichkeitsprodukt von PbCl2 berechnen. Ich hab zwar ein Ergebnis, aber ich vermute es ist falsch, denn ich finde überall den Wert von 1,6 × 10^-5 mol^3/l^3, was ich nicht raus habe.
Ich hab mal meine Lösung in den Anhang gemacht. Ist das richtig? Oder was hab ich falsch gemacht?
Gegeben ist: die Löslichkeit beträgt 1,08g pro 100 ml
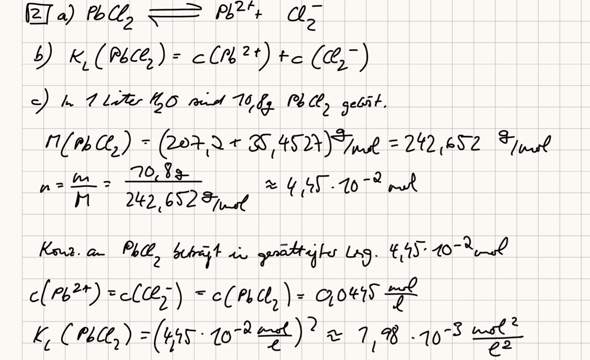
Vielen Dank für eure Hilfe!
2 Antworten

Da sehe ich vorne und hinten nicht durch, was Du gemacht hast.
Es lösen sich also 10.8 g PbCl₂ pro Liter Wasser, das sind n=m/M=0.039 mol/l (die molare Masse von PbCl₂ ist 278.1 g/mol). Folglich ist die Konzentration der Pb²⁺-Ionen 0.039 mol/l, und die der Cl¯-Ionen ist doppelt so groß also 0.078 mol/l.
Das Löslichkeitsprodukt beträgt also Kₛₚ = c(Pb²⁺)⋅c²(Cl¯) = 2.3⋅10¯⁴ mol³/l³.
Das entspricht nicht dem Literaturwert, aber es steht ja auch nicht dabei, bei welcher Temperatur diese Löslichkeit gilt.

Bleichlorid ist PbCl₂ (es gibt auch ein PbCl₄, aber das ist kein Salz). Beim Lösen dissoziiert es in drei Ionen Pb²⁺ + 2 Cl¯, und das Löslichkeitsprodukt ist das Produkt von allen, also Kₛₚ=c(Pb²⁺)⋅c(Cl¯)⋅c(Cl¯)=c(Pb²⁺)⋅c²(Cl¯)


- Zeile. Es gibt kein Cl2- es sind 2 Cl-
- Du hättest sehen müssen/können, dass die Einheit mol³/L³ ist. Also brauchst du auch drei Konzentrationen!
- KL ist das PRODUKT der Konzentrationen, nicht deren Summe!
also nochmal von vorn ...
Danke.
Ist es dann Ksp (PbCl2) = c(Pb^2+) × c(Cl2^-) oder Ksp (PbCl2) = c(Pb^2+) × c^2(Cl2^-)?