Zwitterionische Form?
Muss man alle COOH oder NH2 Gruppen deprotonieren/protonieren, damit man in die zwitterionische Form kommt? Muss ein Zwitterion nicht immer eine ingesamt neutrale Ladung haben? Im folgenden Beispiel wäre es doch dann -1, wenn ich alle deprotonieren würde?
Beispielsweise hier:
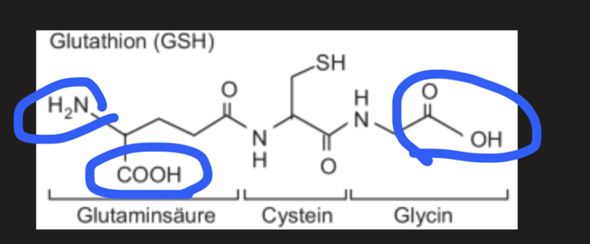
1 Antwort

Ja, im ungefähr neutralen Bereich liegt das Ding als Anion vor: Die COOH-Gruppen sind deprotoniert, die NH₂-Gruppe ist protoniert. Im Alkalischen bekommst Du ein Trianion, weil dann auch die Amino- und die Thiolgruppen deprotoniert vorliegen. Hier ein Bild:
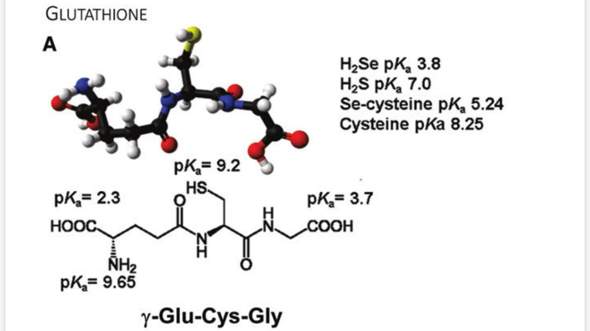
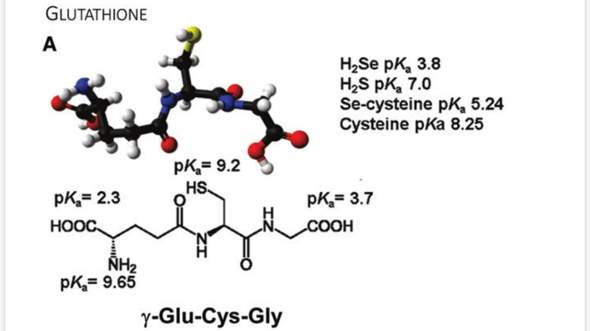

Ja, aber im stärker Sauren kann immer noch ein echtes Zwitterion gebildet werden: Bei pH≈3 sollte die linke COOH-Gruppe vorwiegend deprotoniert und die rechte vorwiegend protoniert sein, und dann dominiert die neutrale (=zwitterionische) Spezies

Danke! Also wenn ich es richtig verstanden habe: Die zwitterionische Form muss nicht insgesamt eine Ladung von 0 haben, sondern es müssen alle NH2 und COOH Gruppen protoniert/ deprotoniert sein?
Aber ist die Definition von zwitterionischen Molekülen nicht, dass sie neutral sein sollten in einem elektrisch angelegten Feld? Wenn beide COOH Gruppen deprotoniert sind, dann wäre die Ladung ja -1?